肺癌可起源于囊性空腔包括肺气肿型巨大肺大疱和囊肿等。前期的研究表明,肺癌可能与先天性囊性疾病,包括囊性腺瘤和肺气道畸形存在相关性。通用术语囊性空腔指肺组织中的空气填充区域,包括纤维化囊肿,空泡和肺大疱,伴或不伴肺气肿。
近日,Farooqi等报道一项关于老年吸烟者或曾经吸烟者的低剂量计算机断层扫描筛查发现3.6%的肺癌患者存在囊性空腔。
为了进一步明确肺癌CT形态学特征和囊性空腔之间的关联,进一步明确CT扫描对囊性肺癌的定义,并分析胸部FDG-PET对诊断这部分肺癌患者的意义。来自意大利的Mario Mascalchi教授等开展了一项研究,研究结果发表在J Comput Assist Tomogr杂志上。
该研究纳入24例(17例腺癌,7例鳞状细胞癌,术后病理12例为I期,12例为Ⅱ~Ⅳ期)囊性肺癌患者的资料,研究者分析计算机断层扫描(CT)和18F-FDG正电子发射断层扫描(FDG-PET)与囊性肺癌的相关性。
FDG-PET葡萄糖分级:轻度 (SUVmax ≤ 3),中度 (SUVmax >3 but ≤5)和重度 (SUVmax > 5).
该研究发现,空腔的平均直径为17.6mm(范围5-30mm),研究者将这部分患者分为4类影像学模式:实性结节向囊壁外(I型,N=5)或囊壁内(II型,N=4)生长;囊壁四周增厚(III型,N=8);囊肿内混合肿瘤组织(IV型,n=7)。
I-IV型示意图:
随着肿瘤生长,9例患者空腔缩小,6例患者空腔增大,9例患者空腔未见明显变化。五例患者从III型发展为I型,5例患者病灶变为实性。7例患者FDG-PET葡萄糖的摄取率为轻中度,14例患者为中重度。
I型患者的CT及PET的影像学表现:
I型患者的3年CT随访:
II型患者CT随访:
II型患者的3年CT随访:
III型患者的3年CT随访:
III型患者的2年CT随访及PET表现:
III型患者的CT随访:
IV型患者的CT随访:
IV型患者的CT及PET的影像学表现:
鉴于此,研究者认为对于存在囊腔壁增厚,或存在囊腔内外结节进行性增大的患者应高度怀疑肺癌的可能。FDG摄取率对这部分患者的诊断并无特异性。
小编寄语:空洞型肺癌发生率:活体发现此型肺癌的发生率为2%~15%,尸检为12%~29%。空洞表现为囊样者则更少,strang在1930例肺癌中有癌性空洞70例,囊样空洞仅4例;国内报道11例癌性空洞,表现为囊性仅1例,本院928例肺癌中,囊样空洞54例,占5.7%。鳞癌易形成空洞,Chandhuri报道100例空洞肺癌,鳞癌82例。
关于囊样空洞癌形成原因,一般认为癌瘤生长在小细支气管壁上,随着生长瘤体增大,使管腔完全阻塞,造成远端肺泡膨胀破裂,形成肺囊腔,癌组织支气管壁侵入囊腔形成壁结节影。peabady描述1例肺癌起源于肺囊肿的壁上,初为囊内壁结节影,随着肿瘤的发展 ,壁上结节不断增大,或成多个。
最近国内的临床医生越来越关注囊性肺癌,该文研究者将囊性肺癌的影像学表现进行分类值得一读。
原文题目:Lung Cancer Associated With Cystic Airspaces
注:感谢浙江省台州医院-胸外科同道Rock供稿!
摘要:本研究旨在明确囊性肺癌的CT形态学变化和FDG-PET的摄取量特征。
方式:共回顾24例囊性肺癌患者的CT和PET(18F-FDG),其中腺癌17例,鳞癌7例,Ⅰ期12例,Ⅱ~Ⅳ期12例。
结果:囊性病变的初始平均直径为17.6 mm(5~30 mm),按形态学可大致分为4类:“I型:实性结节向囊外突出(5例)”,”II型:实性结节向囊内突出(4例)“,“III型:囊壁增厚型(8例)”,“IV型:囊内组织混杂型(7例)”。随着肿瘤的生长,9例病灶的囊腔缩小,6例增大,9例不变。其中5例病灶由III型发展为I型,病灶完全实变。首次PET的FDG摄取值轻度7例,中重度14例。
结论:当CT发现进行性的囊壁增厚、囊腔内外出现结节或结节增大时,应提高警惕。而FDG摄取值的改变无特异性(低摄取值仍有恶性可能)。
肺癌可以起源于囊泡璧,包括肺大疱、肺囊肿等。在成人中,现在普遍认为先天性囊性疾病(包括囊性腺瘤和肺气道畸形)可能与肺癌有关。“囊性空腔”是指肺内离散的充气区域,包括纤维性囊肿、空泡和肺大疱(不考虑病理结果,不论是否存在肺气肿)。最近Farooqi报道,在成人或老年吸烟者或既往吸烟者中,经低剂量CT筛查发现的肺癌患者3.6%存在囊性空腔。
抱着以下3个目的,作者回顾性分析了24例合并囊性空腔病灶的肺癌病例:(1)进一步明确肺癌和囊性空腔的形态学特征间的关联(2)研究随时间发展这类病灶在CT下的演变(3)研究病灶FDG-PET摄取值的诊断意义。
方法
意大利两所大学附属医院(Careggi, Florence and S. Orsola Malpighi, Bologna)放射科5年来在CT中观察到的成人肺癌病例,构成了本次回顾性研究(地方伦理委员会批准)的基础。作者收集到54例囊性肺癌病例。恶性肿瘤的诊断依据为CT引导下细针穿刺活检细胞学检查(n=18)/手术标本或活检的组织学诊断(n=6)。肿瘤分期基于临床判断或病理结果。对于前者,T的界定考虑了CT上包括“囊性、实性或非实性成分”在内的整个病灶的直径。
值得注意的是,因为肺癌空洞可能看起来类似于囊性肺癌,排除了缺乏既往CT,而不能证明CT发现肿瘤前存在囊性成分的病例。在两家医院的图像档案系统中,检索所有入选患者的CT和FDG-PET检查。共71次CT检查和24次FDG-PET检查符合纳入标准。调查的追溯性及其隐含的多中心性意味着CT和FDG-PET有不同的参数,这些参数在不同的扫描仪和多个中心完成。CT薄层厚度从1mm(47次)、3mm(15次)到5 mm(9次)不等。此外,病灶标准摄取值(SUV)对于某些PET研究无法利用 。
由两位胸科放射科医生(M.M.和M.Z.),统一审查24例患者中所有可用的CT检查,并确定:(1)病变位于胸膜下或肺内;(2)囊腔最大直径;(3)固体或非固体结节的最大直径(如有);(4)囊壁增厚,累及部分周长。此外,他们还评估了其余肺是否存在肺气肿、及其类型和严重程度,以及是否存在其他囊性空隙、间质性肺疾病、支气管扩张或纤维化。根据以前的文献和目前的结果,他们分为4型来描述囊性肺癌的CT形态学特征(图1)。I型:从囊腔壁向外挤出的结节;II型:局限在囊性空间腔内的结节;III型:沿着囊腔壁延伸的软组织密度;IV型:多个囊性病灶混合的固体或非固体组织。最后一种类型被Maki等人认为是I型的变体,但是,这类的病变具有高度特异性,可将其作为一种单独的类型。
最后,他们在一系列CT中评估了囊性空隙的大小、形态学变化,以及双成分病灶转变为实性肿块的可能性。
PET图像由2名核医学医生独立评价(A.V.和V.A.),他们估测了18F-FDG摄取情况。当SUV可用时,他们将病灶的SUV考虑在内,并将病灶摄取分级为无、轻度(SUVmax≤3)、中度(SUVmax>3但≤5)和高度(SUVmax>5)。
结果
研究者发现了24例囊性肺癌(表1)。其中17名男性和7名女性(平均年龄70.6岁,51-85岁)。18名患者(15名仍在吸烟者,3名既往吸烟者)有吸烟史。22例患者因各种原因进行了CT检查,其中有肺癌病史者(n=6例)、肺外肿瘤史(n=3例)和无肿瘤病史(n=13例)。24位囊性肺癌患者中17例为腺癌和7例为鳞癌。4例为囊性肺癌合并单对侧(n=3)或单同侧(n=1)肺实质病变,细胞学或组织学诊断为腺癌,并同时诊断为原发性肺癌(图6)。在24例囊性肺癌患者中,早期(9例Ia期和3例Ib期)有12例(50%),不同程度地进展期(1例IIa期,2例IIb期,4例IIia期和5例IV期)有12例(50%)。
每位患者均接受过2~4次CT检查。首次和末次CT的间隔时间平均为16个月(3~39个月)。患者囊性间隙位于胸膜下4例,肺内20例。24例患者中有17例还合并肺气肿,轻度(占全肺的5%~10%)14例,中度(占全肺的15%~30%)3例。无巨型肺大疱患者。2例合并肺纤维化和肺气肿,表现为下叶轻度非特异性间质性肺炎(NSIP)和上叶轻度肺气肿。肺部其余位置,CT未发现其他类型的囊肿或支气管扩张。
根据初次CT显示,囊腔直径(在多个囊状空间群集的情况下,考虑最大囊肿)平均17.6 mm(范围6~30 mm)。初始CT形态分布包括I型(图2和3)5个,II型(图4和5)4个,III型(图6-8)8个,IV型(图9和10)7个。
系列CT下观察到病灶的演变如下:
在5个I型病变中,1例无变化,2例腔璧处结节增大,1例囊壁完全环状增厚(演变为III型),1例病灶完全实变(图3)。
在4个II型病变中,3例实质成分增加(图4),1例完全实变。
在8个III型病变中,5例出现从囊性腔壁中向外发展的结节(病变演变为I型)(图8),1例无变化,1例的囊性空隙周围出现磨玻璃状阴影(图6),1例病灶完全实变。
在7个IV型病变中,4例显示囊团内实质组织增多(图9),1例未发生改变,2例完全实变(图10)。
综上所述,24例囊性病变(1个I型,1个II型,1个III型,2个IV型)中有5例(21%)最终变为完全实性。对比初次和后续CT结果,发现随着固体成分的增加,9例囊腔直径减小(图3-6和8-10),6例增大(图7),9例囊腔直径不变。
有17名患者接受过1次FDG-PET检查(表2)。其中2个病灶18F-FDG摄取缺失(图2),1个病灶轻度摄取,5个病灶中度摄取,9个病灶明显摄取(图7和10)。
另4名接受过2次PET检查的患者中,病灶摄取量随着时间的推移均有增加。3例第一次PET无摄取,至第二次PET发展为中度摄取(n=2)或明显摄取(n=1)。1例第一次PET摄取较轻,第二次PET摄取中度。
讨论
虽然巨型肺大疱是肺癌的高发因素早已为人所知,直到近期,人们才注意到肺癌和较小的囊性空间之间也可能存在联系。在过去的10年里,CT扫描的广泛使用,胸部CT使用的临床指征增加,包括对肺部和肺外恶性肿瘤的随访以及对胸片异常的进一步检查等。在成年和老年吸烟或既往吸烟者中进行低剂量CT肺癌筛查,进一步提升了每年接受胸部CT扫描者的数量。
对细胞学或组织学证实的囊性肺癌患者的CT和PET检查进行回顾性分析性。根据CT图像归纳出4种形态模式。前3个是由Maki等人提出的,但他们的病例包括患有巨大大疱性肺病的患者。而在我们的研究中,不包括巨大大疱疾病患者。此外,我们倾向于将与肺癌相关的囊性空隙群集的病例视为独立的IV型,而Maki等人则将多发性囊肿合并为I型变异型。事实上我们的建议是合理的,肿瘤在多个囊性病灶的集群内生长更据隐蔽性,它的检测往往更困难。
对比多次CT扫描,观察肿瘤生长相关的形态学演变。在多数患者中,囊腔的壁最初较薄,并会随着时间的推移逐渐变厚。随着周围组织逐渐受累,病灶会出现结节(从III型病变过渡到I型病变),或者原有结节渐渐变大。随着病灶实质成分的增加,囊性间隙一般会缩小,24例中有5例最终消失,取而代之的是完全实性的病变。这些现象表明,囊性肺癌的发生频率可能被低估了。
此外,在我们的队列中,还有很重要一小部分(6/24):随着肿瘤的生长,其囊腔的大小随之增大,这可能与囊性空间相连的远端气道上的瓣膜机构有关。
疑似肺癌的病灶常规会评估FDG摄取,但据我们所知,目前还没有关于囊性肺癌的具体研究。我们研究发现,这类病灶往往表现相对轻度或缺乏18F-FDG摄取。随着肿瘤的生长和侵袭,其实性部分代谢需求增加,18F-FDG摄取也增加。相反,病灶的囊状空腔部分有明显降低摄取率和SUV的效应,尤其是当囊腔部分占比较大时。随着肿瘤的生长,空腔与固体部分的比例的可能会降低,导致这部分体积的效应下降,从而增加病变摄取和SUV。
最后,需要注意的是,在病例队列中,有一半的病例是在不同程度的肿瘤晚期才被诊断出为囊性肺癌。如果能意识到囊性肺癌早期可能表现为缺乏或轻度摄取FDG,并了解其发展过程,应该有助于避免延误诊断。
该研究仍存在局限性。首先,这是一项回顾性研究,必然有一些数据存在缺失,并妨碍对囊性病灶中发生肺癌的总体频率的估计。而且,这种事件应该并不罕见。其次,多数情况下,我们是按照FNAB进行诊断,这种方式缺乏对囊肿腔壁的组织学评估,不能确定它的组织学性质(肺大疱、胸膜小泡或纤维性囊肿),尽管这种区分在病理基础上也比较困难。第三,没有计算病灶倍增时间来评估病灶生长速度。这是由于明确的区分病灶的两个组成部分十分困难,尤其是在IV型模式的情况下。
结论
囊性疾病和肺癌的关联现象,常常能在成年吸烟者或既往吸烟者接受CT检查时被偶然发现。发现囊腔壁的渐进性增厚或囊腔周围的结节的出现/增大时,应提高对肺癌的警惕。随着实质病变的生长,囊腔的直径可以减小、增大或保持稳定。意识到这些CT特征十分重要,因为它可以避免延误诊断,同时也要考虑到这些病变的FDG摄取是非特异的,有时甚至会表现为无摄取。建议进行密切的CT随访或微创诊断,如:CT引导下的细针穿刺活检,以及时诊断囊性肺癌。
原文题目:Lung Cancer Associated With Cystic Airspaces
以前遇到一个患者,CT显示肺上一个很小的、类似“气泡”的不明来历的结构,我们觉得没什么,定期随访即可,但是为了以防万一,还是告诉患者家属,有手术切除的必要时,虽然必要性不是很大。 患者出院后2周,想不通,担心万一是绝症,又回来手术。结果,病理示肺腺癌。让我们大跌眼镜! 问一问wenyiwen
什么是肺大泡?
《高分辨率肺部CT》这样解释:边缘清楚、壁<1毫米、直径>=1厘米的肺气肿区。
箭头所指,是什么?典型的肺大泡。
下面这些,都是肺大泡。

■ 例1 下面这个CT,是什么?
诊断:肺囊性病变(肺囊肿?肺大泡?)。
建议:定期复查。
患者说,既然诊断不明确,那就切了,要不然晚上睡不着!手术一做,病理:腺癌!做了手术,还是睡不好。 事后诸葛亮分析:感觉像是2个肺大泡凑合在一起,内壁不光滑,边缘有点毛毛糙糙的。
■ 例2 下面这个,又是什么鬼?似曾相识,像显微镜下的细胞,像满肺的气泡。
支气管扩张?壁不太厚。
多发肺大泡?壁又太厚。
肺穿刺:肺鳞癌。
■ 例3 下面这个,乍一看,很典型的肺大泡啊。
这个不是肺大泡,还能是什么?别被吓到了。 但是,患者某一天有了超能力,居然误吸了缝衣针!把缝衣服的针,误吸到左下肺!不敢想象。 纤支镜都拿不出来,于是乎,左下肺切除。 病理:肺大泡伴肺中分化腺癌。病理镜下示肿瘤细胞沿肺泡壁及肺大泡壁生长,部分区域间质见肿瘤细胞浸润。 神奇了,这个不是简单的肺大泡,是肺大泡和肺癌长在一起了。单选题:肺大泡合并肺癌。 肺气肿同学,你肿么了?癌变了?还是合并肺癌?不得而知。 下面这个,又是什么?
四不像,有一点像小盆友的鼻涕泡。
肿么办?定期复查。
3年后,这个气泡实变了。病理:鳞癌。
■ 例4 下面这个气泡,肺大泡周围感染了?还是感染引起气囊?
四不像就是四不像,千万不能把四不像诊断成肺大泡,也不能诊断为肺囊肿!
病理:右肺下叶浸润性肺腺癌。
下面白色箭头所指的这位“四不像”同志,你笑得太狰狞了,你再笑我把你切了。
切了,病理:腺癌。
事后诸葛亮分析:气囊里面乱糟糟的,有粗大分隔,外面毛糙,提示恶性病变可能。
■ 例5 随访增大的,常常不是好事。
病理:腺癌。
事后诸葛亮分析:气囊增大,并且壁增厚,要命了。
■ 例6 下面这个圈圈。
肺气肿?壁太厚,肺气肿的壁一般很薄,不支持。那是什么?
食管癌肺转移。
■ 例7 四不像,随访很重要。
下面这个类似肺大泡的四不像,是什么?不知道!
定期随访。
半年以后,“四不像”开始变得有模有样。
后来再随访,实性成分再增多。手术切除,病理:腺癌。
■ 例8 女,中年人,发热、咳嗽1月。
这个小圈圈,内壁光滑,壁略厚,不是肺大泡。
肺癌?
NO,这种气囊要考虑肺癌,但不一定都是肺癌。
这个是空洞型肺结核。
■ 例9 四不像,最像肺大泡,但又不是很像,下面乱糟糟的。
病理:鳞癌。
事后诸葛亮:这个病灶,胸片估计很容易误诊为肺大泡。 ■ 例10 看图,都是肺癌,注意:里面有相对粗大分隔,或者壁上有实变、结节。


后记
1954年,英国的Anderson和Pierce首先报道了表现为囊性病变的肺癌。哪些病会表现为气囊?肺大泡、先天性囊性病变、结核和肺真菌病等等,以及肺癌、金葡菌感染等。注意鉴别。因为肺癌强调早期治疗,要警惕。


参考文献:
王中瑜, 王志新. 囊性肺癌误诊一例报告[J]. 临床误诊误治, 2011, 24(s1).
2.张巧丽, 陈众博, 周成伟,等. 双肺弥漫结节与囊腔影[J]. 中华结核和呼吸杂志, 2017, 40(12).
3.何苗, 曾庆思, 陈淮. CT诊断周围型囊性空洞型肺癌2例[J]. 中国医学影像技术, 2010, 26(9):1806-1806.
4.望云, 刘士远, 范丽,等. 含薄壁囊腔周围型肺癌的CT特征及病理基础分析[J]. 中华放射学杂志, 2017, 51(2):96-101.
5.郭俊唐, 梁朝阳, 初向阳,等. 薄壁空洞性肺癌:24例病例分析及文献回顾[J]. 中国肺癌杂志, 2014(7):553-556.
6.李晓冰, 徐强, 张春华. 薄壁空洞型肺癌的CT影像分析[J]. 中国辐射卫生, 2008, 17(3):368-369.
7.代平, 欧光乾, 刘勇,等. 薄壁囊腔类肺癌与薄壁空洞性肺结核MSCT诊断对比研究[J]. 放射学实践, 2018(04):389-393.
8.望云. 薄壁囊腔型肺癌的MDCT检查技术优化与CT征象分析研究[D]. 第二军医大学, 2016.
9.Iwata T, Nishiyama N, Nagano K, et al. Squamous cell carcinoma presenting as a solitary growing cyst in lung: a diagnostic pitfall in daily clinical practice.[J]. Annals of Thoracic & Cardiovascular Surgery, 2009, 15(3):174-177.
10.HUI DENG1, JINGYUAN ZHANG1, SHENG ZHAO2. Thin-wall cystic lung cancer: A study of 45 cases .DOI: 10.3892/ol.2018.8707.
11.Nakahara Y, Mochiduki Y, Miyamoto Y. Percutaneous needle washing for the diagnosis of pulmonary thin-walled cavitary lesions filled with air.[J]. Internal Medicine, 2007, 46(14):1089-94.
囊性肺癌是肺癌的一种特殊类型,发病率较低。在国际早期肺癌行动计划筛查中发现,囊型肺癌的发病率约为 3.6%[Farooqi AO, Cham M, Zhang L, et al. Lung cancer associated with cystic airspaces. AJR Am J Roentgenol, 2012, 199(4): 781-786.]。在CT上主要表现为环形透亮区,由不同厚度壁环绕,多数小于2mm。由于多数病变在CT仅表现为孤立的薄壁空腔,与肺大泡、肺囊肿等空腔病变相似,从而造成误诊、漏诊。提高对囊性肺癌的认识,早期发现此类肺癌,可以显著减少误诊、漏诊,提高肺癌患者的生存率。
近年来,囊性肺癌受到了广泛的关注,越来越多的学者对其进行了报道及描述。这类肺癌在 CT 上具有相同的特征,即孤立的薄壁含气空腔。目前国际上对其有明确定义:即在CT上表现为由不同厚度的囊壁环绕(通常小于2mm),其中薄壁的范围多在50%~75%之间,空腔内可含有气体、液体或实性成分。[Watanabe Y, Kusumoto M, Yoshida A, et al. Cavity wall thickness in solitary cavitary lung adenocarcinomas is a prognostic indicator. Ann Thoracic Surg, 2016, 102(6): 1863-1871.]
印戒征是囊性肺癌在CT上的一种特殊表现,由一个中心为圆形或类圆形含气低密度区与其外周的圆形或不规则形软组织密度影相连而成,形似印戒(图1)。圆形或类圆形含气低密度区通常是囊壁和其内部的空腔,圆形或不规则形软组织密度影多为肿瘤实质。
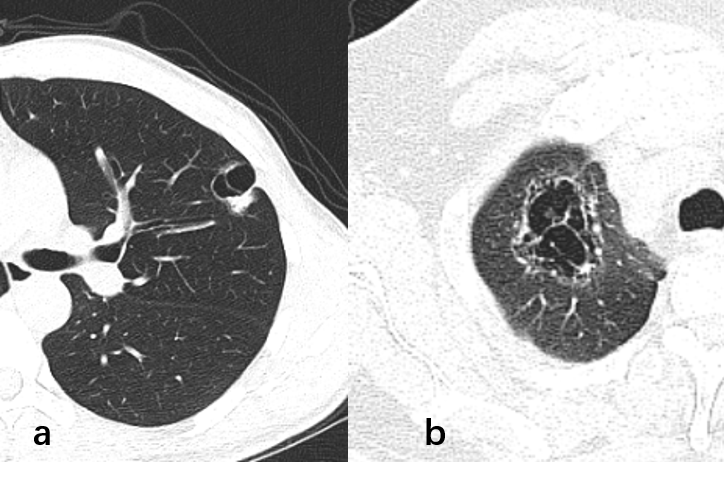
图1 印戒征型囊性肺癌与其他类型囊性肺癌
a印戒征型囊性肺癌:病变位于左肺上叶,周围型腺癌,由中心为圆形含气低密度区与其外周的圆形或不规则形软组织密度影相连而成,形似印戒,可见胸膜牵拉;b其他类型囊性肺癌:病变位于右肺上叶,周围型腺癌,囊腔内见分隔,边缘可见磨玻璃成分,囊内可见壁结节。
囊性肺癌目前可能的形成机制包括[Qi Y, Zhang Q, Huang Y, et al. Manifestations and pathological features of solitary thin-walled cavity lung cancer observed by CT and PET/CT imaging. Oncol Lett, 2014, 8(1): 285-290. ]:
(1)单向阀机制,由于细支气管及终末细支气管缺乏软骨,沿终末细支气管生长的肿瘤细胞堵塞细支气管,起到了活瓣作用,随着肿瘤细胞对肺泡壁的破坏以及肺泡腔内气体的逐渐累积,肺泡壁破裂融合,形成薄壁空腔。目前,该机制被大多数学者所认可。
(2)实性病变中心液化、坏死,经支气管排出后形成薄壁空腔。多项研究表明,此机制与厚壁空洞型肺癌形成机制有关。囊性肺癌镜下表现均未见坏死肿瘤细胞,考虑此机制发生较少。
(3)肿瘤继发于原有的薄壁空腔病变,如肺大泡、肺囊肿、肺气肿等。肺部空腔型病变也可以导致局部肺组织通气不足,引起致癌物质沉积,致癌物质可以抑制抗弹性蛋白酶活性,使得肺泡间隔破坏,从而导致囊腔的形成。