关高娃 康静波 张新红 徐云科 方恒虎 闫晓梅 展晓宇 张嘉月
海军总医院肿瘤诊疗中心
摘 要:
目的 探讨射波刀在早期非小细胞肺癌治疗中的疗效与安全性。方法 回顾性分析海军总医院28例接受射波刀治疗的早期非小细胞肺癌患者(Ⅰ、Ⅱ期),处方剂量为28~52 Gy(中位剂量42.2 Gy),分3~7次给予。等剂量曲线水平为65%~87%(中位水平为80%)。结果 疾病控制率96.4%,随访5~26个月(中位时间15个月),1年无进展生存率为96.4%,总生存率100%。发生ⅠⅡ级乏力16例(57.1%),ⅠⅡ级放射性肺炎5例(17.9%),无Ⅲ级及以上不良反应。结论 射波刀治疗早期非小细胞肺癌局部控制率高、不良反应轻,可作为早期非小细胞肺癌患者的根治手段之一。
关键词:
射波刀; 非小细胞肺癌; 放射治疗;
肺癌为最常见的恶性肿瘤之一,是全球癌症患者的首要死亡原因。据统计,肺癌组织学分类75%为非小细胞肺癌( non-small cell lung cancer,NSCLC) ,其中10% ~ 15% 的NSCLC为早期( Ⅰ~Ⅱ期) 患者,手术切除是此类患者的主要治疗方法; 但对于高龄、合并内科疾病而不能或拒绝接受手术的患者,放射治疗占有重要地位[1,2]。传统的常规分割放射治疗效果差,单独行此治疗患者5 年生存率仅为15% ,低于手术治疗的32% ~ 68% 。近年来,立体定向放射治疗( stereotactic body radiation therapy,SBRT) 显示出明显的量效关系,局部控制率明显改善。有研究显示,早期NSCLC经SBRT治疗,完全缓解率可达33% ~ 61% ,局部控制率> 95% ,中位生存时间34 ~ 45 个月,SBRT已经成为不能手术的早期NSCLC患者的标准治疗[3,4,5]。而射波刀作为新型的SBRT设备,治疗时能够实时图像引导追踪,解决呼吸运动所致移位误差,进一步提高了治疗的精确性,在早期NSCLC患者的治疗中显示出独特的优势。本研究回顾性分析海军总医院28 例经射波刀治疗的早期( Ⅰ~Ⅱ期) NSCLC患者的病例资料,并评价临床疗效及放疗不良反应。
1 资料与方法
1.1一般资料
回顾性分析海军总医院2013 年7月 —2015 年8 月收治的早期NSCLC患者共计28例,男性19 例、女性9 例,中位年龄71( 43 ~ 88) 岁,Karnofsky功能状态评分≥70 分。按照国际抗癌联盟标准进行分期,Ⅰ期17 例、Ⅱ期11 例。24 例经穿刺活检病理证实,其中腺癌18 例、鳞癌6 例; 其余4 例拒绝穿刺活检,以PET/CT为诊断依据。
1. 2 方法
1.2.1追踪方法
据病灶位置情况,12例临近椎体的患者采用脊柱追踪技术,16例采用呼吸同步肺追踪技术。所有患者均采用真空垫仰卧位固定,行4D-CT扫描下定位,扫描范围为全肺、层厚1.5 mm。
1.2.2靶区及处方剂量
靶区在肺窗勾画,靠近肺门病灶结合纵隔窗勾画,肿瘤位于上肺及中肺的治疗靶区为肿瘤区各方向外扩5 mm,肿瘤位于下肺的治疗靶区在肿瘤区头足方向上外扩8~10 mm。危及器官包括双肺、脊髓、食管等邻近脏器。处方剂量为28~52 Gy,中位处方剂量42.2 Gy,分3~7次给予,同时计算等效生物剂量,1/d、5/周。
1.2.3评价标准
随访开始时间为射波刀治疗结束时,随访截止时间为2016 年1 月,随访时间为5~ 26 个月( 中位时间15 个月) 。
所有患者每3 个月复查胸部增强CT,以胸部CT影像学上的变化为判断标准。采用实体瘤新的疗效评价标准对近期疗效进行评价: 完全缓解( complete remission,CR) 为所有目标病灶消失; 部分缓解( partial remission,PR) 为基线病灶直径总和缩小30% 及以上; 进展( progression disease,PD) 为基线病灶直径总和增加≥20% 或出现新病灶; 稳定( stable disease,SD) 为基线病灶直径总和有缩小但未达PR或有增加但未达PD。
观测指标包括总有效率即[( CR + PR) /病例总数] × 100% 、疾病控制率( disease control rates,DCR) 即[( CR + PR + SD) / 病例总数]× 100% 、总生存期及放射损伤。放射损伤采用美国放射治疗肿瘤协作组急性放射性损伤分级标准,分0 ~ Ⅳ级,主要观察放射性肺炎及食管炎、咳嗽及咳痰、胸痛情况。
1.3统计学处理
应用SPSS 19.0软件,组间比较采用χ2检验,Kaplan-Meier计算方法分析生存率及局部控制率,生存曲线比较采用Log-Rank检验。生存时间自开始射波刀治疗之日起进行计算。P<0.05为差异有统计学意义。
2 结果
2.1近期疗效
所有患者均顺利完成射波刀治疗,其中CR 6 例、PR 18 例、SD 3 例、PD 1 例,治疗总有效率85. 7% ,DCR 96. 4% ( 表1) 。
2.2远期疗效和生存率
随访5 ~ 26 个月,中位随访时间15 个月,随访率100% 。28 例在随访期间,其中2 例原位复发、4 例出现肺内转移,至随访结束4 例死于其他伴发疾病。28 例的1 年无进展生存率96. 4% ,1 年总生存率100% ( 图1) 。
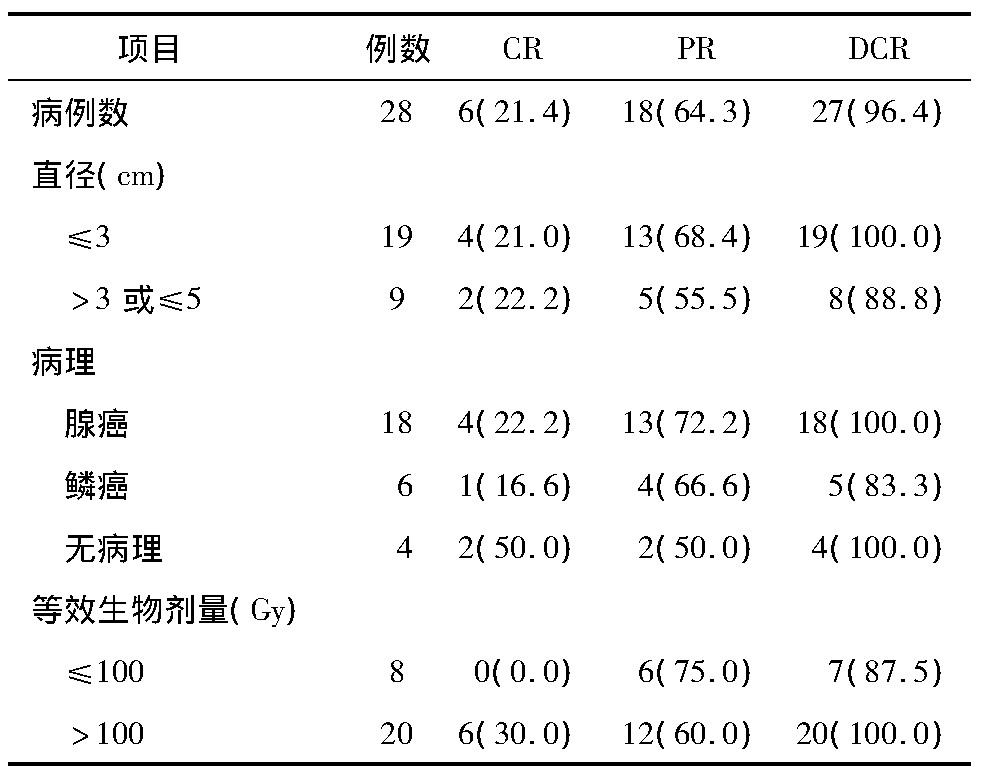
表1 射波刀治疗28 例早期NSCLC患者疗效[n( %) ]
注: CR、PR、DCR患者在肿瘤直径、等效生物剂量比较,χ2直径= 4. 875、χ2剂量=4.365,P<0.05
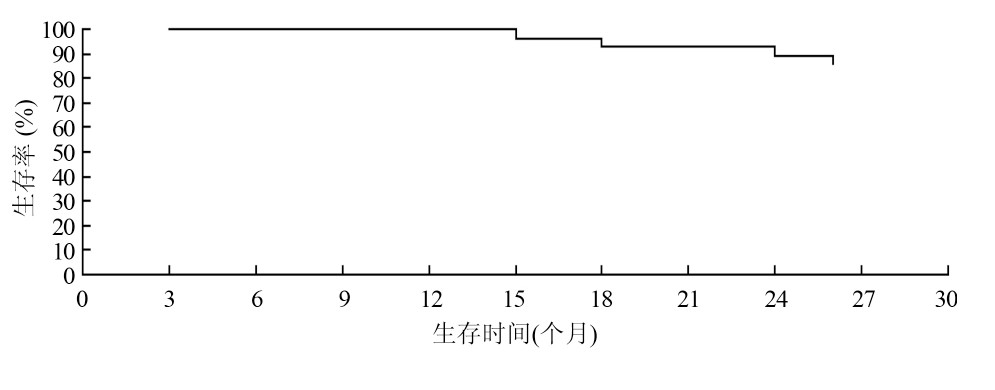
图1 28 例生存曲线
2.3不良反应
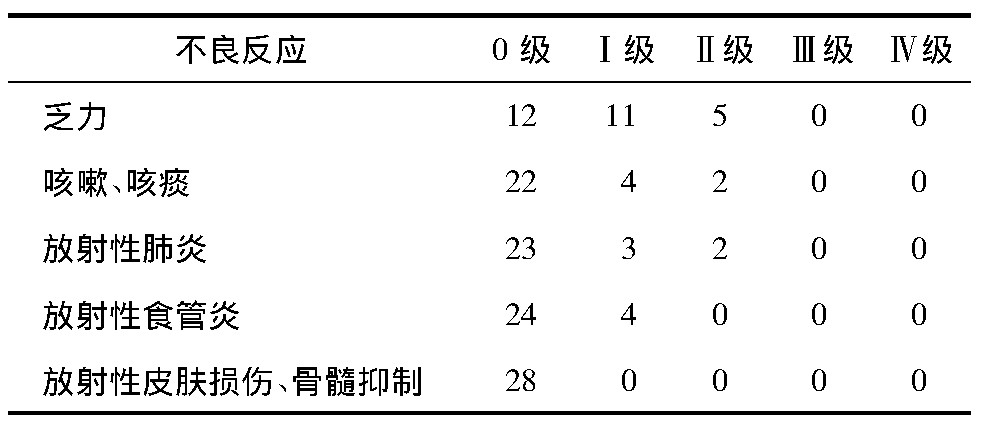
所有患者均顺利完成射波刀治疗,无一例因治疗相关不良反应而中止,其中主要不良反应为乏力、咳嗽及咳痰,发生Ⅰ~Ⅱ级放射性肺炎5 例( 17. 8% ) ,Ⅰ ~ Ⅱ 级疲乏16 例( 57. 1% ) ,无 Ⅲ级及以上不良反应。所有患者无骨髓抑制、胸痛、放射性皮肤损伤的发生( 表2) 。
表2 28 例治疗相关不良反应( n)
3 讨论
肺癌是最常见的恶性肿瘤之一,其发病率及病死率逐年上升。手术是早期NSCLC的标准治疗,术后5 年生存率Ⅰ、Ⅱ期分别是55% ~ 72% 、29% ~51% 。但是部分患者因高龄、合并严重内科疾病不能或不愿接受手术,对于这部分患者,放疗提供了可能根治的机会,是目前标准治疗模式。以往常规分割的传统放疗方法,局部控制率仅为40% ~ 70% ,5年生存率为6% ~ 30% ,并可引起严重的放射性肺炎及食管损伤。
射波刀作为新型SBRT技术,采用实时呼吸同步追踪定位系统,定位精确,减少了因呼吸运动造成的计划靶体积的增加,增加了治疗精确度以及放射生物效应,明显提高了肿瘤的局部控制率[3],减少了正常组织的受照射范围,大大降低了治疗的不良反应。多项研究证明,SBRT已经成为不能手术的早期NSCLC患者的标准治疗[4,5,6,7],局部控制率可达95% ~ 100% ,甚至达到与手术一样的治疗效果[8,9,10]。Onishi等[5]报道采用SBRT治疗的 Ⅰ 期NSCLC患者共计87 例,放疗剂量为45. 0 ~ 72. 5Gy /3 ~ 10 F,放疗中位随访时间55 个月,其中CR28 例( 32. 2% ) 、PR 43 例( 49. 4% ) ,5 年的局部无进展生存率86. 7% ,5 年的无进展生存率92. 0% 。Shen等[11]报道的一项50 例Ⅰ期NSCLC患者经射波刀治疗,中位剂量为57 Gy,中位随访35 个月,局部控制率92% ,2 年DCR 96% ,1 年及2 年总生存率分别为86% 和74% 。但因缺乏长期随访资料,其远期生存及晚期不良反应仍需观察[12,13,14,15]。
本研究回顾性分析了海军总医院28 例接受射波刀治疗的早期NSCLC患者,治疗剂量高、肿瘤直径小患者的疗效明显优于治疗剂量相对较低、肿瘤直径较大患者,结果与文献报道相符[16]。
射波刀治疗早期NSCLC的局部控制率高、疗效确切、不良反应轻,为不愿和不能接受手术治疗的早期NSCLC患者提供了根治性治疗的机会。但射波刀治疗在国内开展时间尚短,临床治疗病例数相对较少,无大宗的临床数据分析,治疗总剂量与分割次数尚需进一步探索。本研究为回顾性研究,病例数有限,随访时间较短,对于患者的长期局部控制率、远期疗效及不良反应仍需观察。
参考文献
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-E386.
[2]Boffa DJ.The revised stage classification system for primary lung cancer[J].Clin Chest Med,2011,32(4):741-748.
[3]Castelli J,Thariat J,Benezery K,et al.Feasibility and efficacy of cyberknife radiotherapy for lung cancer:early results[J].Cancer Radiother,2008,12(8):793-799.
[4]Xia T,Li H,Sun Q,et al.Promising clinical outcome of stereotactic body radiation therapy for patients with inoperable stageⅠ/Ⅱnon-small-cell lung cancer[J].Int J Radiat Oncol Biol Phys,2006,66(1):117-125.
[5]Onishi H,Shirato H,Nagata Y,et al.Stereotactic body radiotherapy(SBRT)for operable stageⅠnon-small-cell lung cancer:can SBRT be comparable to surgery?[J].Int J Radiat Oncol Biol Phys,2011,81(5):1352-1358.
[6]Andratschke N,Zimmermann F,Boehm E,et al.Stereotactic radiotherapy of histologically proven inoperable stageⅠnon-small cell lung cancer:patterns of failure[J].Radiother Oncol,2011,101(2):245-249.
[7]Palma D,Lagerwaard F,Rodrigues G,et al.Curative treatment of stageⅠnon-small-cell lung cancer in patients with severe COPD:stereotactic radiotherapy outcomes and systematic review[J].Int J Radiat Oncol Biol Phys,2012,82(3):1149-1156.
[8]Chen VJ,Oermann E,Vahdat S,et al.Cyber Knife with tumor tracking:an effective treatment for high-risk surgical patients with stageⅠnon-small cell lung cancer[J].Front Oncol,2012,2:9.
[9]Vahdat S,Oermann EK,Collins SP,et al.Cyber Knife radiosurgery for inoperable stageⅠA non-small cell lung cancer:18F-fluorodeoxyglucose positron emission tomography/computed tomography serial tumor response assessment[J].J Hematol Oncol,2010,3:6.
[10]Wang YY,Lin SX,Yang GQ,et al.Clinical efficacy of Cyber Knife combined with chemotherapy and hyperthermia for advanced non-small cell lung cancer[J].Mol Clin Oncol,2013,1(3):527-530.
[11]Shen ZT,Wu XH,Li B,et al.Clinical outcomes of Cyber Knife stereotactic body radiotherapy for peripheral stageⅠnon-small cell lung cancer[J].Med Oncol,2015,32(3):55.
[12]Wu VW,Tam KW,Tong SM.Evaluation of the influence of tumor location and size on the difference of dose calculation between Ray Tracing algorithm and Fast Monte Carlo algorithm in stereotactic body radiotherapy of nonsmall cell lung cancer using Cyber Knife[J].J Appl Clin Med Phys,2013,14(5):68-78.
[13]Swangsilpa T,Yongvithisatid P,Pairat K,et al.Preliminary experience of Cyber Knife treatment of primary non-small cell lung cancer[J].J Med Assoc Thai,2012,95(10):1335-1343.
[14]Agarwal R,Saluja P,Pham A,et al.The effect of Cyber-Knife therapy on pulmonary function tests used for treating nonsmall cell lung cancer:a retrospective,observational cohort pilot study[J].Cancer Manag Res,2012,4:347-350.
[15]Lv Y,Wang Z,Zhu X,et al.Preliminary effect of Cyberknife radiosurgery in the treatment of 31 patients with advanced non-small cell lung cancer[J].Zhongguo Fei Ai Za Zhi,2011,14(4):329-334.
[16]Davis JN,Medbery C 3rd,Sharma S,et al.Stereotactic body radiotherapy for early-stage non-small cell lung cancer:clinical outcomes from a National Patient Registry[J].J Radiat Oncol,2015,4(1):55-63.
2 射波刀在非小细胞肺癌中的应用
2.1 射波刀单独使用
2.1.1 早期肺癌
手术切除是早期非小细胞肺癌的主要治疗方法, 治愈率可达80%, 5年生存率可达70%, 但有年龄偏大部分患者, 心肺功能差、合并其他内科疾病或不愿手术等原因, 可以采用射波刀治疗, 取得了较好的疗效, 没有发现较严重的并发症。Brown等[2]使用射波刀治疗了67例Ⅰ期非小细胞肺癌, 处方剂量为60~67.5 Gy, 等剂量线为60%~80%, 分割治疗3~5次, 1年局部控制率为93.2%, 4.5年的局部控制率为85.8%, 1年的生存率为93.6%, 4.5年的生存率为83.5%, 全部患者的肺功能没有变化, 只观察到了4例放射性肺炎和1例放射性食管炎, 且毒性分级均在1~2级。Vahdat等[3]应用PET/CT追踪随访射波刀治疗20例IA期非小细胞肺癌, 处方剂量42~60 Gy, 平均为51 Gy, 分割3次, 2年总生存率为90%, 局部控制率为95%, 平均肿瘤最大18-氟脱氧葡萄糖摄入值射波刀治疗前为6.2 (范围为2.0~10.7) , 治疗后早期为2.3 (范围为1.0~5.7) , 治疗后18~24个月为2.0 (范围为1.5~2.8) 。Bibault等[4]通过射波刀治疗了22例肺癌患者, 随访了3~16个月, 肺癌局部控制率为100%, 最主要并发症为1级放射性肺炎, 发生率为25%, 没有3级及以上的严重并发症被观察到。Agarwal等[5]研究对比37例射波刀治疗前、后的早期肺癌患者的肺功能, 在统计学上没有发现明显的差异。上述研究显示射波刀治疗早期非小细胞肺癌, 局部控制率较高, 获得了较好的生存率, 且没有较严重的并发症, 提高了患者的生活质量, 已成为治疗不能手术或不愿接受手术的早期非小细胞肺癌患者的首选方法, 甚至将来可能取代早期非小细胞肺癌的手术治疗。
2.1.2 中晚期肺癌
由于肺癌早期无明显临床表现, 大部分肺癌患者确诊时都已是中晚期, 出现了肺内、颅脑、骨骼等部位转移, 此时已无法手术, 生存时间明显缩短, 使用射波刀治疗, 可明显减轻患者相应的症状, 延长生存期。Swangsilpa等[6]采用射波刀治疗6例不能手术治疗肺癌, 处方剂量:周围型肺癌45 Gy, 分割为连续3次, 中央型肺癌50 Gy, 在2周内分割为5次, 其中2例取得了完全缓解, 3例取得了部分缓解, 未发现严重的并发症。Tian等[7]应用射波刀治疗了38例非小细胞肺癌脑转移患者, 1年脑转移局部控制率为50.8%, 1年生存率为53.5%。国内外资料显示, 即使对常规放疗后或放化疗后复发的肺癌及脑部、骨骼转移灶, 也取得了较好的疗效, 没有严重的并发症, 延长了患者的生存期[8,9,10,11]。
2.2 射波刀与化疗、生物疗法及热疗等的联合应用
由于射波刀是一种局部精确放疗, 对肺癌或其转移灶有较好的局部控制率, 但对预防或降低肺癌的转移率方面却没有明显效果, 为进一步提高肺癌的治疗疗效, 延长患者的生存时间, 提高生存率, 近年来, 部分作者采用射波刀联合化疗、热疗或靶向药物治疗中晚期肺癌, 取得了一定的疗效。Wang等[12]使用射波刀联合化疗、热疗治疗119例中晚期非小细胞肺癌, 其中射波刀单独治疗37例, 射波刀联合化疗治疗39例, 射波刀联合化疗、热疗治疗43例, 中位随访6个月, 三组近期有效率分别为62.16%、71.79%和90.70%, 经统计学检验, 射波刀联合化疗、热疗组明显优于前两组, 在毒性反应方面, 虽有所增加, 但可以耐受, 经对症处理并不影响整个治疗计划。王振等[13]应用射波刀联合表皮生长因子受体络氨酸激酶抑制剂厄洛替尼或吉非替尼治疗24例晚期非小细胞肺癌患者, 中位随访14个月, 患者症状改善率为61%, 疾病控制率为62.5%, 局部控制率为75%, 中位生存时间为9个月, 1年生存率为66.7%, 主要的不良反应为乏力、皮疹和口腔溃疡, 未见严重的不良反应。Wang等[14]使用射波刀联合CIK生物免疫治疗中晚期非小细胞肺癌, 随访3月, 疾病有效率为81.82%, 患者卡氏评分比治疗前平均提高20分左右。
3 射波刀治疗肺癌优点
3.1 高精确性
射波刀通过靶区立体定位影像追踪系统、呼吸同步追踪系统 (金标植入肺追踪系统和脊柱定位追踪系统) , 使治疗肿瘤的误差缩小至1 mm, 高精确性, 最大限度减少了肺癌特别是周围型肺癌周围正常组织的损伤[15]。Hoogeman等[16]分析通过呼吸肿瘤追踪使用射波刀治疗的44例肺癌的记录数据, 与没有呼吸追踪的呼吸运动形成的几何图形的误差比较, 呼吸追踪明显减少了几何图形的误差, 提高了精确度。
3.2 治疗周期短、高剂量和低分割
由于高精确性, 射波刀照射单次剂量较高, 可达到5~20 Gy[17], 照射3~5次, 1次/d, 单次40~90 min, 总体治疗时间短, 部分可在门诊治疗, 灵活方便。
3.3 避免放射损失, 提高放疗疗效
常规放疗由于治疗周期长, 单次剂量低, 5年生存率仅为15%~24%[18], 而射波刀高剂量、低分割, 避免了放射损伤, 提高了放疗的生物剂量, 减少了局部治疗失败和复发的概率[19,20]。
3.4 减少放疗次数和并发症
单个部位多个肿瘤可以同时治疗, 因而减少了放疗次数和并发症, 节约了医疗费用。Yang等[21,22]用射波刀分别治疗1例肺癌脑部24个转移灶患者和1例肺腺癌纵隔15个转移灶患者, 前者总剂量22 Gy, 分割3次, 治疗后患者的头痛、恶心和呕吐等症状明显减轻, 未见明显的不良反应, 生存1年。后者总剂量35 Gy, 分割5次, 治疗后患者咳嗽等症状明显减轻, 未见明显并发症。
4 射波刀治疗肺癌的不足
4.1 照射总剂量和分割次数没有公认的标准
目前国内外肺癌的射波刀治疗总剂量:根据经验周围型肺癌一般为40~60 Gy, 分割3次, 中心型肺癌一般为50~60 Gy, 分割5次[23,24], 标准的放射总剂量和分割次数没有得到公认, 根据剂量效应关系, 射波刀的最大剂量尚无定论。射波刀在国内应用临床时间较短, 治疗剂量和分割次数一般参考国外经验, 没有考虑到国内外种族差异等因素。
4.2 准备工作较复杂
射波刀治疗周围型非小细胞肺癌, 治疗前1周, 一般要在CT引导下经皮穿刺置入金标1~3枚, 置入金标与射波刀治疗间隔时间稍长, 且部分可引起患者出现气胸等并发症[25,26,27], 甚至有时可发生金标漂移[28], 射波刀治疗的精确依赖于置入金标的稳定性和可靠性, 如果出现金标漂移, 则金标置入失败, 无法进行射波刀治疗。
4.3 其他
射波刀是一种高效的局部精确放疗, 无法预防肿瘤转移和控制全身多发转移肿瘤, 因此需要联合化疗、生物治疗等全身性的治疗方法。
综上所述, 可见射波刀系统是一种新型的全身立体定向放射治疗技术, 它将6 MV直线加速器、灵活的自动化机器人机械臂、X线实时影像定位系统、呼吸同步追踪系统、自动化治疗床和计算机网络集成与控制系统完美地结合起来, 使放射治疗进入了一个崭新时代, 由三维立体定向放射治疗上升到四维立体定向放射治疗, 提高了精确度, 缩短了治疗周期, 对非小细胞肺癌治疗, 特别是早期无法手术的非小细胞肺癌, 取得了较好的疗效, 且不良反应小, 可以耐受。但因射波刀治疗在国内开展时间尚短, 临床治疗病例数相对较少, 治疗总剂量和分割次数尚需进一步探索。射波刀与化疗、热疗等其他治疗方法具体联合应用, 尚需进一步观察和研究。
参考文献
[1]Yang Y, Li H, Hou S, et al.The noncoding RNA expression profile and the effect of lnc RNA AK126698 on cisplatin resistance in non-small-cell lung cancer cell[J].PLo S One, 2013, 8 (5) :78.
[2]Brown WT, Wu X, Fayad F, et al.Application of robotic stereotactic radiotherapy to peripheral stage I non-small cell lung cancer with curative intent[J].Clinc Oncol, 2009, 21 (8) :623-631.
[3]Vahdat S, Oermann EK, Collins SP, et al.Cyberknife radiosurgery for inoperable stage IA non-small cell lung cancer:18Ffluorodeoxyglucose positron emission tomography/computed tomography serial tumor response assessment[J].J Hematol Oncol, 2010, 4 (3) :6.
[4]Bibault JE, Prevost B, Dansin E, et al.Stereotactic radiotherapy for lung cancer:Non-invasive real-time tumor tracking[J].Cancer Radiother, 2010, 14 (8) :690-697.
[5]Agarwal R, Saluja P, Pham A, et al.The effect of cyberknife therapy on pulmonary function tests used for treating non-small cell lung cancer:a retrospective, observational cohort pilot study[J].Cancer Manag Res, 2012, 4 (3) :347-350.
[6]Swangsilpa T, Yongvithisatid P, Pairat K, et al.Preliminary experience of cyberknife treatment of primary non-small cell lung cancer[J].J Med Assoc Thai, 2012 Oct, 95 (10) :1335-1343.
[7]Tian LJ, Zhuang HQ, Yuan ZY.A comparison between cyberknife and neurosurgery in solitary brain metastases from nonsmall cell lung cancer[J].Clin Neurol Neurosurg, 2013, 115 (10) :2009-2014.
[8]Bondiau PY, Doyen J, Mammar H, et al.Reirradiation of spine and lung tumor with cyberknife[J].Cancer Radiother, 2010, 14 (6-7) :438-441.
[9]Leeman JE, Clump DA, Wegner RE, et al.Prescription dose and fractionation predict improved survival after stereotactic radiotherapy for brainstem metastases[J].Radiat Oncol, 2012, 11 (7) :107.
[10]Lv Y, Wang Z, Zhu X, et al.Preliminary effect of cyberknife radiosurgery in the treatment of 31 patients with advanced non-small cell lung cancer[J].Zhongguo Fei Ai Za Zhi, 2011, 14 (4) :329-334.
[11]Fumagalli I, Bibault JE, Dewas S, et al.A single-institution study of stereotactic body radiotherapy for patients with unresectable visceral pulmonary or hepatic oligometastases[J].Radiat Oncol, 2012, 7 (1) :164.
[12]Wang YY, Lin SX, Yang GQ, et al.Clinical efficacy of cyberknife combined with chemotherapy and hyperthermia for advanced non-small cell lung cancer[J].Mol Clin Oncol, 2013, 1 (3) :527-530.
[13]王振, 朱锡旭, 武新虎, 等.射波刀联合EGFR-TK1治疗24例晚期非小细胞肺癌临床观察[J].医学研究生学报, 2012, 25 (4) :357-362.
[14]Wang YY, Wang YS, Liu T, et al.Efficacy study of cyberknife stereotactic radiosurgery combined with CIK cell immunotherapy for advanced refractory lung cancer[J].Exp Ther Med, 2013, 5 (2) :453-456.
[15]Wu VW, Tam KW, Tong SM.Evaluation of the influence of tumor location and size on the difference of dose calculation between ray tracing algorithm and fast monte carlo algorithm in stereotactic body radiotherapy of non-small cell lung cancer using cyberknife[J].J Appl Clin Med Phys, 2013, 14 (5) :68-78.
[16]Hoogeman M, Prévost JB, Nuyttens J, et al.Clinical accuracy of the respiratory tumor tracking system of the cyberknife:assessment by analysis of log files[J].Int J Radiat Oncol Biol Phys, 2009, 74 (1) :297-303.
[17]Gibbs IC, Loo BW Jr.Cyberknife stereotactic ablative radiotherapy for lung tumors[J].Technol cancer Res Treat, 2010, 9 (6) :589-96.
[18]Grutters JP, Kessels AG, Pijls-Johannesma M, et al.Comparison of the effectiveness of radiotherapy with photons, protons and carbon-ions for non-small cell lung cancer:a meta-analysis[J].Radiother Oncol, 2010, 95 (1) :32-40.
[19]Glatstein E.Hypofractionation, long-term effects and alpha/beta ratio[J].Int J Radial Oncol Biol Phys, 2008, 72 (1) :11-2.
[20]Brown JM, Koong AC.High-dose single-fraction radiotherapy:exploiting a new biology[J].Int J Radial Oncol Biol Phys, 2008, 71 (3) :324–325.
[21]Yang G, Wang Y, Wang Y, et al.Cyberknife therapy of 24multiple brain metastases from lung cancer:A case report[J].Oncol Lett, 2013, 6 (2) :534-536.
[22]Yang G, Li M, Wang Y, et al.Successful treatment of nonsmall cell lung tumor with 15 lesions by cyberknife radiosurgery:A case report[J].Exp Ther Med, 2013, 6 (3) :808-810.
[23]Chen VJ, Oermann E, Vahdat S, et al.Cyberknife with tumor tracking:An effective treatment for high-risk surgical patients with stage I non-small cell lung cancer[J].Front Oncol, 2012, 2 (1) :9.
[24]Goldsmith C, Gaya A.Stereotactic ablative body radiotherapy (SABR) for primary and secondary lung tumours[J].Cancer Imaging, 2012, 12 (3) :351-360.
[25]Schroeder C, Hejal R, Linden PA.Coil spring fiducial markers placed safely using navigation bronchoscopy in inoperable patients allows accurate delivery of cyber knife stereotactic radiosurgery[J].J Thorac Cardiovasc Surg, 2010, 140 (5) :1137-1142.
[26]Unger k, Ju A, Oermann E, et al.Cyberknife for hilar lung tumors:report of clinical response and toxicity[J].J Hematol Oncol, 2010, 3 (1) :39.
[27]Snider JW, Oermann EK, Chen V, et al.Cyberknife with tumor tracking:An effective treatment for high-risk surgical patients with single peripheral Lung metastases[J].Front Oncol, 2012, 2 (1) :63.
[28]沈泽天, 武新虎, 李兵, 等.射波刀治疗I期周围型非小细胞肺癌疗效的临床观察[J].肿瘤, 2013, 33 (7) :610-618.