止血障碍在恶性肿瘤中的发生率较高,主要表现为高凝状态或易栓状态。大量研究已表明,肿瘤细胞表达的各种促凝物质是引起高凝状态的主要原因,且肿瘤细胞的促凝活性对肿瘤的生长和转移亦有重要作用。
组织病理学
应用免疫化学或电子显微镜检测可发现,在原发癌、转移癌及肿瘤周围组织中有纤维蛋白,同样也可发现,血小板血栓与生长中的肿瘤细胞紧密结合,提示肿瘤的纤维蛋白沉积和血小板激活可能在宿主对肿瘤生长的反应中起重要作用。轻度的反应可限制肿瘤生长,但过度的反应对宿主有害(产生血栓),而利于肿瘤(促进血管生成和肿瘤生长)。
有实验证实,在大鼠和人的肿瘤中有与纤维蛋白原相关的蛋白(FRPs),其在肿瘤中的分布可为癌症患者高凝状态的发生原因提供重要线索。FRPs的解剖分布因肿瘤而异,其沉积在围绕肿瘤细胞的基质中,在肿瘤基质中心区则不明显。应用抗体鉴定FRPs,可验证纤维蛋白原和各种相关的蛋白,包括未交联和交联的纤维蛋白、纤维蛋白原及纤维蛋白降解产物。另外,纤维蛋白在肿瘤中的沉积也因肿瘤类型而不同。
高凝状态的发生机制
已有报道显示,50%的癌症患者和90%的转移癌患者有1至数个凝血参数异常。最常见的包括凝血因子水平升高(如纤维蛋白原,因子Ⅴ、Ⅷ、Ⅸ和Ⅺ)、纤维蛋白原/纤维蛋白降解产物(FDP)增加和血小板增加。
癌症患者高凝状态的发生机制十分复杂,关键的作用是肿瘤细胞特殊的促凝机制。恶性肿瘤细胞可通过多种途径与止血系统相互作用,概括起来可分为两类:其一,肿瘤细胞的活性,包括促凝活性、纤维蛋白溶解活性和释放细胞因子;其二,肿瘤细胞与其他细胞的相互作用,如内皮细胞、血小板和单核细胞。
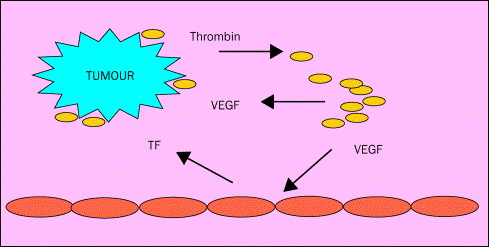
肿瘤细胞的活性
大量文献已报道,肿瘤细胞可表达各种促凝物质(PCA),其中已明确的是组织因子(TF)和癌促凝物(CP)。TF是47
KD的穿膜糖蛋白,与因子Ⅶ形成大分子复合物,从而激活因子Ⅹ和Ⅸ。CP是68
KD的半胱氨酸蛋白酶,可直接激活因子Ⅰ而不依赖因子Ⅶ。对这两种主要促凝物的表达和调节的了解有助于探讨恶性肿瘤凝血激活的病理生理并监测肿瘤的治疗反应。在人的肿瘤中还发现了其他PCA,如肿瘤细胞膜上伴有因子Ⅴ受体的微体,这有助于组合凝血酶原复合物。
多数肿瘤细胞的表面能表达纤溶系统所需的全部蛋白如尿激酶型(u-PA)和组织型纤溶酶原激活剂(t-PA),也能产生纤溶酶原激活剂抑制物1和2(PAI-1和PAI-2)。另外,肿瘤细胞膜上存在特殊的受体。通过受体介导的纤溶系统激活可能是白血病患者发生出血的原因,纤溶活性的受损可能是实体瘤患者血栓形成的原因。近年来的报道表明,纤溶酶原激活剂及其抑制物的失衡可能在肿瘤细胞增殖、肿瘤浸润和转移中发挥作用。已有研究发现,这些蛋白中的一种或多种在部分恶性肿瘤中是患者无病生存和长期生存的指标。
肿瘤细胞产生的炎性细胞因子如肿瘤坏死因子2(TNF-2)、白细胞介素1β(IL-1β)及脂多糖(LPS或内毒素)可使内皮细胞表达TF和PAI-1,下调凝血酶调节蛋白(TM),从而可使蛋白C系统的激活降低,而蛋白C是重要的抗凝物质。此外,肿瘤细胞还分泌一种多肽即血管内皮生长因子(VEGF),其在肿瘤血管生成中起重要作用。部分肿瘤细胞TF基因的高表达可引起VEGF基因的高表达,表明凝血过程、炎性细胞因子和恶性肿瘤生长及转移之间有重要的相互作用。肿瘤新生血管的高通透性使血浆漏出造成比容增加、血黏度增高、血流淤滞从而易发生血栓。
肿瘤细胞与其他细胞的相互作用
肿瘤细胞可间接或直接与内皮细胞发生相互作用。间接作用指肿瘤细胞合成和释放的炎性细胞因子减低内皮细胞的抗血栓性、增强内皮细胞促血栓形成,直接作用是肿瘤细胞通过膜黏附分子黏附于血管内皮或内皮基质。IL-1β和TNF-α激活内皮细胞可增加内皮细胞表达黏附分子,肿瘤细胞附着于血管壁后通过释放内皮细胞的细胞因子及促使白细胞和血小板黏附,从而促进局部的凝血激活和血栓形成。
已有研究表明,肿瘤细胞可激活血小板,使血小板聚集和释放活性物质。肿瘤细胞表面的黏液素为恶性肿瘤细胞在血流中与血小板、白细胞和内皮细胞的相互作用提供了条件。血小板与肿瘤细胞形成复合物可保护肿瘤细胞抵抗宿主的免疫防御体系。肿瘤细胞引起的血小板聚集(TCIPA)有利于血栓形成和微血栓形成。研究显示,肿瘤细胞可引起血小板分泌VEGF,刺激血管增生,同时VEGF也是肿瘤进展的指征。
肿瘤细胞或肿瘤细胞产物可与单核-巨噬系统相互作用,使其细胞表达TF。有报道显示,癌症患者的巨噬细胞比对照患者的巨噬细胞表达更多的TF,这可能与癌症患者的高凝状态有关,也可能与肿瘤组织中纤维蛋白的沉积有关。
由此可见,肿瘤细胞自身影响着止血作用的各个方面如凝血、抗凝、纤溶及血小板等,这不仅造成了恶性肿瘤患者的高凝状态或易栓状态,而且还有利于肿瘤细胞的生长和转移。
引起高凝状态的外来因素
多种危险因子均可引起癌症患者的高凝状态。抗肿瘤疗法如单一或多种药物化疗、激素治疗和血液细胞生长因子治疗等都不可避免地参与了静脉和动脉的血栓形成。
化疗可改变凝血因子和自然抗凝物的水平,降低纤溶活性、直接损伤内皮细胞。已有研究表明,49例Ⅱ期乳腺癌患者化疗前和化疗中出现激活的部分凝血活酶时间(APTT)和凝血酶时间(TT)缩短;环磷酰胺+甲氨蝶呤+5氟尿嘧啶(CMF)治疗的Ⅱ期乳腺癌患者,蛋白C和蛋白S抗原水平和活性降低70%~90%,而PAI-1水平升高;40例Ⅲ期和Ⅳ期肺癌患者接受化疗后,t-PA明显下降,而PAI-1水平升高。另有研究发现,多柔比星、长春新碱和博来霉素可引起内皮细胞收缩和血小板黏附,而内皮细胞收缩可暴露内皮下基质,从而启动凝血系统激活。体外实验显示,内皮细胞与化疗后的血浆温育后与血小板的反应性增强,但化疗前的血浆无此作用。
由于年龄、肿瘤类型和分期等因素,难以确定每种化疗药物引起高凝状态的原因和危险程度,但目前我们对少数抗肿瘤药物,如L-门冬酰胺酶引起高凝状态的作用有较多了解。L-门冬酰胺酶通过减低血浆中蛋白合成所需的L-门冬氨酸而抑制白细胞的生长,也可降低肝生成的多种蛋白质如纤维蛋白原、纤溶酶原、抗凝血酶、蛋白C及蛋白S等的水平。有报道显示,儿童和成人急性淋巴细胞白血病患者接受L-门冬酰胺酶治疗,血栓栓塞并发症的发生率为1.1%~14.3%。亦有报道提示,应用L-门冬酰胺酶可导致血浆中特别大的血管性血友病因子多聚体增加,而这种特殊的多聚体可增强血小板凝集,促进血栓栓塞。
已有报道表明,抗雌激素药物他莫昔芬是引发静脉血栓的危险因子。在一项双盲临床研究中,1.3万名健康妇女接受他莫昔芬治疗的4年随访结果显示,他莫昔芬可防止乳腺癌的发生,但年龄为50岁以上的患者经他莫昔芬治疗后,深静脉血栓和肺栓塞的发生率有所增高。采用他莫昔芬治疗时可观察到抗凝血酶和蛋白C
水平下降。
血细胞生长因子,如粒细胞集落刺激因子(G-CSF)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)已广泛应用于抗癌治疗。一项研究表明,在962例接受GM-CSF和884例接受G-CSF治疗的患者中,静脉和动脉血栓的发生率为2.8%,其中GM-CSF组为4.2%,G-CSF组为1.2%,表明GM-CSF致血栓并发症的危险性较高,具体机制尚不明确,可能与CSF增加中性粒细胞表面黏附分子的表达,而GM-CSF使中性粒细胞黏附于血管的作用比G-CSF更强有关。
肿瘤发生的止血异常有血栓形成和弥散性血管内凝血(DIC)。与其他原因发生的血栓有所不同,它一般影响下肢深静脉,而且是孤立的,肿瘤的静脉血栓可以是游走性的,可累及浅静脉和深静脉,及一些少见的部位,如上臂和胸部。有些病例对抗凝治疗无效,在一些癌症患者,静脉血栓可以是首发症状,在患者还无任何其他症状时出现,直到数月甚或数年才发现肿瘤。
易并发血栓的肿瘤
Sack等综合文献报道指出:最常见的并发血栓的肿瘤好发于胰腺、肺和胃。Lieberman通过回顾性的系列分析报道,在男性中肺癌和胰腺癌是最常并发血栓形成,而在女性中最常见并发血栓的是妇科肿瘤,如子宫内膜癌和卵巢癌。
VTE和隐匿性癌
Trousseau报道的血栓性静脉炎是恶性肿瘤的先兆,但是有关原发性深部静脉血栓的患者有发生癌的危险还存在争论。虽然不少学者认为,原发性深部静脉血栓是隐匿性癌的信号,但是仍然有些学者质疑对这种患者严格的观察有无隐匿性癌是否合宜。一般认为在年龄大的患者若出现原发性深部静脉血栓应该警惕是否有隐匿性癌,在男性应注意前列腺癌、结肠癌和膀胱癌,而在女性应注意结肠癌、乳腺癌和子宫内膜癌,应进行相关的筛选检验。
高凝状态的病因学
已有报道:50%癌症患者和90%有转移瘤患者显示1至数个凝血参数异常。最常见的包括凝血因子水平升高(如纤维蛋白原、因子Ⅴ、Ⅷ、Ⅸ和Ⅺ),纤维蛋白原/纤维蛋白降解产物(FDP)增加和血小板增加。癌症患者高凝状态的发病机制十分复杂,一般的因素如发生急性相反应、蛋白代谢异常、坏死、血液动力学的改变(如卧床导致瘀血)都会有助于凝血的激活,但是关键的作用是由于肿瘤细胞特殊的促凝机制。恶性肿瘤细胞可以通过多种途径和止血系统相互作用,基本上可分为2类,其一,肿瘤细胞的活性,包括促凝活性、纤维蛋白溶解活性和释放细胞因子,如白细胞介素(IL-1)、肿瘤坏死因子(TNF)和血管内皮生长因子(VEGF);其二,直接与其他血细胞相互作用,如内皮细胞,血小板和单核细胞。
(一)肿瘤细胞的促凝活性
肿瘤细胞与血细胞的相互作用包括内皮细胞、血小板和单核细胞巨噬细胞。
肿瘤细胞可间接的和直接地与内皮细胞作用,间接的作用系指肿瘤细胞合成和释放的炎性细胞因子的影响,即减低内皮细胞的抗血栓性和增强内皮细胞促血栓形成,直接的作用是肿瘤细胞通过膜黏附分子黏附于血管内皮或内皮基质的影响。
肿瘤细胞或肿瘤细胞产物,也可以和单核-巨噬系统作用,并引起这些细胞表达TF,有报道由肿瘤患者分离的巨噬细胞比对照细胞表达更多的TF。这可能与癌症患者高凝状态的发生有关,也与肿瘤组织中纤维蛋白的沉积有关。也有材料显示不同类型癌症患者循环中的单核细胞TF的表达增加。
高凝状态是由于肿瘤细胞本身可以影响止血作用各方面即凝血过程,抗凝,纤溶和血小板,这不仅造成恶性肿瘤患者的易栓状态,而且凝血,血小板等的改变,还有利于肿瘤细胞的生长和转移。
(二) 引起高凝的外在因素
在癌症患者多种危险因子有助于引起高凝状态,抗肿瘤疗法包括单一的或多种的化疗,激素疗法和血液细胞生长因子都不可避免地参与静脉和动脉血栓形成,化疗可改变凝血因子和自然抗凝物的水平,降低纤溶活性和直接损伤内皮细胞。
(三)血细胞生长因子的影响
血细胞生长因子的影响,如G-CSF和GM-CSF已在抗癌治疗中应用,主要用于加速粒细胞的恢复和减低病死率。在1846例应用GM-CSF(962
例)或G-CSF(884例)的癌症患者中,静脉和动脉血栓发生率为2.8%,其中GM-CSF为4.2%,G-CSF为1.2%,说明GM—CSF的血栓并发症的危险性高,尤其在胃肠肿瘤,肺癌、乳腺癌和淋巴瘤。其详细机制尚不明了,但已知CSF可增加中性粒细胞表面黏附分子的表达导致增强中性粒细胞聚集和与血管内皮的结合,而GM-CSF使中性粒细胞黏附于血管作用比G-GSF更强。
肿瘤止血障碍的
临床表现
肿瘤细胞转移和血栓形成是癌症患者主要病死原因,止血障碍的临床表现多种多样,深部静脉血栓(DVT)在实体瘤常见,有弥散性血管内凝血(DIC)在恶性血液病和广泛转移癌中多见。通过凝血检查可发现更多的DIC其他还有血栓性血小板减少(TTP)、溶血性尿毒症症侯群(HUS)。
静脉血栓(VTE)还可发生在肾和肠系膜等少发部位,临床医生应注意,近年来报道癌症化疗所致的致死性并发症,即肝静脉栓塞病(VOD),严重的DIC伴有致死的出血是急性白血病患者,尤其急性早幼粒细胞白血病患者早期死亡的原因,DIC还可引起多器官功能衰竭。
肿瘤止血障碍的诊断
静脉血栓的诊断要依靠超声多普勒、血管造影等方法,特殊部位的静脉血栓有时需要应用碘12.5标记的纤维蛋白原等来确定血栓的位置。
DIC的诊断应参考中华医学会血液学分会制定的DIC诊断标准。
肿瘤止血障碍的
预防和治疗
恶性肿瘤患者合并静脉血栓、肺栓塞可应用抗凝药和溶栓药,抗凝药有华法林、肝素和水蛭素。应该指出的是抗凝药主要阻止血栓的发展,对于已形成的血栓应该应用溶栓药。目前我国应用的溶栓药有尿激酶、重组链激酶和组织型纤溶酶原激活剂(t-PA)。
(一)高凝状态的治疗方法
激活纤溶系统治疗恶性肿瘤时,肿瘤细胞被纤维蛋白包绕,纤溶治疗可使肿瘤细胞由瘤体脱落而失去活力,从而减少肿瘤促凝物的产生和肿瘤的生长,文献已有不少有关的报道。
抗凝药物应用华法林或肝素可以减低肿瘤细胞分泌的组织因子(TF)引起的高凝,而LMWH的作用更为明显,因为它不仅具有通过抗凝血酶介导的抗Xa和凝血酶作用,而且它可升高TFPI水平,从而抑制TF活性。肝素通过抑制肿瘤细胞-血小板联合也抑制了肿瘤转移。
(二)抗血小板药物
如抗血小板糖蛋白Ⅱb/Ⅲa 受体拮抗剂Abciximab不仅抑制血小板聚集,而且还抑制肿瘤生长和血行转移。
(三)新药的应用
近年来已经开发一些抗血管生长的药物,如Endostatin, Angioatatin, 和VEGF抗体,这有利于抑制肿瘤的生长和转移。
2007年美国临床肿瘤学会基于大量文献,发表了肿瘤患者静脉血栓栓栓塞预防和治疗指南,包括:
1. 住院的肿瘤患者是否应该用抗凝药预防静脉血栓栓塞?指南推荐住院的肿瘤患者应该考虑在没有出血和抗凝药其他禁忌证时应用抗凝药预防。
2. 门诊接受系统化疗的肿瘤患者是否应该用抗凝血药预防静脉血栓栓塞?(1)不推荐用抗凝药常规预防。(2)接受Thalidomide 或
Lenalidomide 加化疗,或Dexamethasone 的患者是发生血栓高危者,应该预防。(3)接受Thalidomide 或
Lenalidomide 加化疗和/或Dexamethasone
的多发性骨髓瘤患者需用抗血栓药。(4)急需建立发现门诊肿瘤患者静脉血栓多标志物。
3.
肿瘤患者接受手术是否应该接受围手术期静脉血栓预防?(1)所有接受大手术的恶性病患者都应考虑预防血栓。(2)患者进行开腹手术、腹腔镜检查或开胸手术超过30分钟应该接受药物预防血栓可用小剂量普通肝素或LMWH,除非因为出血高危或活动性出血而禁用。(3)应在手术前预防或在术后尽早开始。(4)机研苑椒?傻揭┪锓椒ǖ?荒苡米骶猜鲅?ㄔし赖奈ㄒ恢瘟疲??且蛭?疃?猿鲅???每鼓??#?)药物和机械的联合方案可改进效果尤其是在高危患者。(6)预防应在术后持续7~10天,在因癌症进行腹部大手术或盆腔手术并有高危特征(如术后残留恶性病)、肥胖患者和既往有静脉血栓栓塞病史者。
4.
已确诊静脉血栓的癌症患者预防静脉血栓复发的最佳疗法是什么?(1)已确诊静脉血栓的癌症患者在抗凝治疗的最初5~10天优先选用LMWH。(2)在长时间抗凝治疗给与至少6个月时,LMWH也是首选,在长时间抗凝治疗不便得到LMWH时也可以用维生素K拮抗剂(INR应达2~3)。(3)6个月后对于特定的进行性癌症患者如有转移瘤和接受化疗者应考虑长期抗凝治疗,这一推荐缺乏临床试验资料,是根据专家小组一致意见提出的。(4)只有对抗凝治疗禁忌和虽然已充分长期LMWH治疗仍然复发静脉血栓的患者才插入静脉滤器。(5)对于CNS恶性病确诊静脉血栓者推荐抗凝药,仔细地监测以限制出血并发症的危险,有活动性颅内出血、近期手术、已有出血素质如血小板减少或凝血异常者应避免用抗凝药。(6)对老年患者已确诊静脉血栓者推荐用抗凝药需要仔细监测和调整剂量以免抗凝药超量和进一步增加出血的危险。
5. 对于未确诊静脉血栓的癌症患者是否应接受抗凝药以改善生存?(1)对于无静脉血栓的癌症患者部推荐应用抗凝药来改善生存。(2)应该鼓励癌症患者参与评价抗凝治疗作为标准抗癌疗法辅助用药的临床试验。
小结
止血障碍在恶性肿瘤中有较高的发生率,主要表现为高凝状态或易栓状态。在临床可出现血栓形成和DIC,静脉血栓形成可以是恶性肿瘤的前驱症状。大量的研究已明确肿瘤细胞表达的TF和促凝物质(PCA)是引起高凝状态的主要原因,而且肿瘤细胞的促凝活性对肿瘤的生长和转移也有重要作用。
采用抗凝药、抗血小板药和溶栓药不仅可以改善患者的高凝状态,也可以抑制肿瘤细胞的生长和转移,在这一方面尚有待进行更多的双盲随机观察以便进一步明确。
恶性肿瘤的噩梦作者:马军 哈尔滨血液病肿瘤研究所 2009-9-21