《Nature》刊发肺癌表观遗传疗法,成功逆转术后转移复发!

每个非小细胞肺癌(NSCLC)患者,都渴望自己能够通过手术——“一次性解决问题”。然而,你不知道的是,即便可以手术,NSCLC(非小细胞肺癌)的术后复发率仍高于30%。导致肺癌死亡的最主要原因,还是肿瘤的的复发和转移。目前,标准化疗只能让术后患者的5年生存率提高3-10%。广大患者报以巨大希望的免疫检查点抑制剂则主要针对初发即是晚期的患者。面对已切除原发灶的肺癌患者,免疫治疗的收效还犹未可知。为了解决术后肺癌患者的复发、转移问题,专家、学者们正在尝试各种新的治疗途径。2011年的一项早期研究,人们发现,使用一种DNA甲基转移酶抑制剂——5氮杂胞苷(5-azacytidine),加上一种组蛋白去乙酰化酶抑制剂——恩替诺特(entinostat),成功的让最初13个患者的复发率下降了近20%(14.3% vs 33.3%)。
临床试验的初步成功,让科学家们对这类影响细胞表观遗传的药物产生了浓厚的兴趣。最近,北京大学肿瘤医院和美国约翰霍普金斯大学医学院联合进行的一项临床前研究,从动物水平验证了表观遗传学制剂对肺癌、乳腺癌、食道癌复发、转移的影响。
由于发现了一个拥有极大开发前景的创新型治疗措施,他们的研究在线发表在今年2月26日的《Nature》主刊上。
在小觅蜂看来,用一句话就可以大致理解表观遗传的含义——“种瓜得豆,种豆得瓜”,意思就是,撒下去的种子和长出来的东西不一样。- 群体的角度,基因决定了生物的门纲目科属种,区别了人与动物、植物的不同。
- 从个人的角度,藏在我们身体里的基因,决定了我们的相貌、高矮、胖瘦。
- 从肿瘤组织和细胞的角度,正是变异的基因决定了肿瘤细胞不受控制的生长。
可是,这并不是绝对的。基因要复制才能传播,要表达才能生成这个栩栩如生的世界。基因的表达实际上受到环境的影响。所谓“橘生淮南则为橘,生于淮北则为枳”,生动表达了这一点。你看,橘子的基因没有变,可是处在不同的环境下,却生长出完全不同的东西来。
目前研究比较透彻的是,生物的遗传物质发生了两件“大事”,影响了物种的表观遗传现象。DNA甲基化:在DNA甲基转移酶的作用下,承载基因的DNA碱基序列部分重要基团被甲基取代了,使这段基因的表达出现了变化,有的基因被“沉默”了,有的则被进一步“活化”——表达更旺盛了。
组蛋白修饰:笼统地说,组蛋白和DNA分子共同组成了染色体。人类等高等真核生物的基因组特别的庞大,却要以一种“超螺旋”的染色体形式浓缩储存在5-10微米的细胞核中,可以说,DNA分子的表达很大程度上受控于组蛋白。例如,部分组蛋白的乙酰化能够释放染色质的局部结构,从而增加基因的表达。
咱们开头提到的那两个化合物——5氮杂胞苷(5-azacytidine)和恩替诺特(entinostat),一种是DNA甲基转移酶抑制剂,另一种是组蛋白去乙酰化酶抑制剂,正是影响细胞表观遗传发挥作用的。其中5氮杂胞苷是合成抗癌药地西他滨的中间产物,恩替诺特则在2013年就被FD批准用于绝经期ER+乳腺癌的二三线治疗。
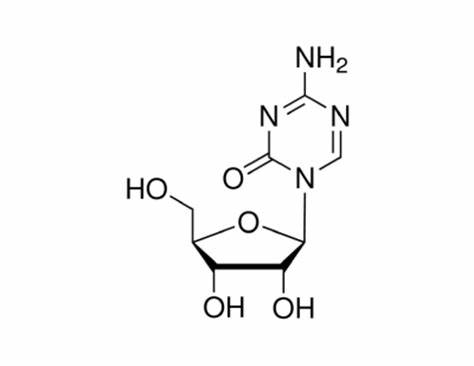
5-氮杂胞苷
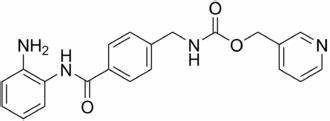
恩替诺特
谁为癌细胞转移做好了准备:影响肺部微环境的MDSCs细胞作为一种生命现象,肿瘤与表观遗传学也有着千丝万缕的联系。几乎所有人类肿瘤都是由基因改变与表观遗传学异常共同引起并促进其演变的。肿瘤的转移正是如此。原来,机体的各大器官在受到复发性的肿瘤侵犯、种植之前,是会受到先期改变的。也就是说,器官所处的组织、细胞的微环境被炎症等因素选择性的改变成一种适合肿瘤细胞生存的“温床”,这时候,肿瘤细胞才会“大摇大摆”的定居于此,引起复发或转移。咱们的身体并不是只会被动等着“死灰复燃”肿瘤细胞来“宰割”,局部的免疫系统总要和“来犯”的肿瘤细胞进行一番搏斗的。如果局部微环境的变化,肿瘤并不能轻易“取胜”,也许一番搏斗之后就甘拜下风、灰飞烟灭了。这次中美两国的科学家们就发现,原来一种叫做——骨髓衍生抑制细胞(MDSCs)参与了肿瘤的转移过程。在肺转移的小鼠模型中,MDSCs能够影响肿瘤切除后形成的微环境,刺激局部产生大量炎性因子,吸引残存的肿瘤细胞前来“定居”。那么如果能减少这种免疫细胞的肺内迁移和聚集,是不是就能逆转肿瘤的转移呢?为了验证这个假说,科学家们找到了一种可以专门“锚定”MDSCs细胞的肽类物质——pep-H6。使用pep-H6在消耗MDSCs的同时,不会影响其他免疫细胞的功能。研究发现,肽介导的MDSCs耗竭,果然使小鼠的无转移生存率(MFS)和总生存率(OS)显著增加了! 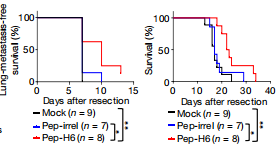
↑ 红线是pep-H6干预MDSCs的生存曲线,蓝线和黑线是对照
谁能阻止MDSCs的迁移作用:低剂量的辅助表观遗传制剂(AET)
研究人员发现,从基因的角度看,CCR2、CCXR2等基因是单核细胞从骨髓向肿瘤微环境迁移的关键调控因子,MDSCs正是通过CCR2成功迁移到肺部,引发肺部炎性反应,营造了全新的、适合肿瘤生存的微环境。
这时候,咱们开头提到的两个表观遗传制剂(AET)就派上了用场。研究发现,低剂量AET可以使MDSCs的CCR2和CXCR2表达下调,让MDSC向间质性更强的巨噬细胞样表型分化,从而阻止了MDSCs像肺实质的迁移,这样一来,肺部转移前微环境也就无法形成了。
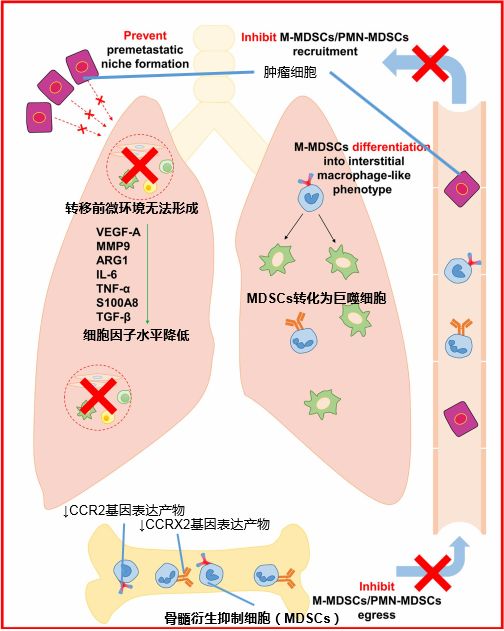
细心的觅友可能会问,刚才说道的那个pep-H6不是刚好可以用来拮抗MDSCs吗?既然也是高选择性的,为啥不直接拿来用呢?这是因为,pep-H6是一种肽体,简单来说有点类似于抗体,属于蛋白质一类的大分子物质,在动物体内很容易引起免疫排斥,造成严重的过敏反应。而像5氮杂胞苷这类的AET表观遗传制剂像传统的TKI靶向药一样属于小分子物质,进入生物体的毒副反应就小多了。为了验证低剂量AET的实际效果,科学家们马上对小鼠的肺癌、乳腺癌、食道癌三个模型进行了AET干预。结果非常成功。和对照组相比,使用低剂量AET(LD-AET)的小鼠肺转移灶显著减少了, 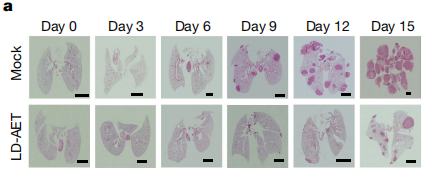
观察小鼠的生存周期发现,低剂量AET能够使转移灶的形成明显延迟,总生存期(OS)大幅提升。 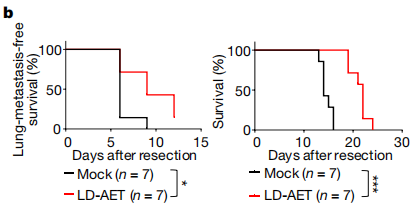
除了验证了AET对生存周期的实际效果,这一研究还有一个惊喜,那就是发现了低剂量AET和CCR2靶向药的协同作用。研究发现,单独使用CCR2拮抗剂没有明显的生存提升,可是联合使用低剂量AET时,能够让AET原本的效果进一步翻倍!联合用药让我们对实现肿瘤“治愈”又有了更大的信心。 
结语:
参与这项研究的主要作者表示,低剂量的辅助表观遗传治疗是一种“靶向”治疗新“姿势”,通过影响肿瘤生长的微环境来阻止肿瘤“死灰复燃”。 这种方法能让癌症的手术成功率大大提高,让术后复发的可能性降至较低的水平。目前已经开始筹备进一步的临床试验,来证实这两个AET制剂的实际临床有效性。
小觅蜂和许多刚刚做完手术的觅友一样,对这项研究抱有很大希望。期待表观遗传学不再被专家和学者“束之高阁”,能够尽快走入寻常百姓家,为广大肿瘤患者造福!
参考文献:
Lu, Z., Zou, J., Li, S. et al. Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature (2020). https://doi.org/10.1038/s41586-020-2054-x
最珍贵的不是你现在有多好,而是经过努力,每一天的自己都比之前更好。点“在看”给我一朵小黄花