2019年12月26日,百济神州自主研发的抗PD-1抗体药物百泽安®(通用名:替雷利珠单抗注射液)正式获得国家药品监督管理局(NMPA)批准,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。
替雷利珠单抗(Tislelizumab,BGB-A317)是一种人源性单克隆抗体,属于免疫检查点抑制剂。
作用机制:
替雷利珠单抗能与细胞表面受体PD-1结合,PD-1在肿瘤细胞逃避免疫系统方面发挥重要作用。替雷利珠单抗可能通过与PD-1结合而恢复CTL杀死癌细胞的能力,且不激活受体,从而阻止PD-L1与PD-1结合。
适应症:
?
用法:
200mg,IV,Q3W。
临床试验:
II期临床研究(NCT03432598)评估了替雷利珠单抗(200mg Q3W)与以含铂为基础的化疗方案(Q3W)联合用于晚期非小细胞肺癌中国患者中的一线治疗。所有的患者接受替雷利珠单抗和含铂双药化疗(4-6个周期)直至疾病进展。其中,提到的含铂双药化疗包括如下:非鳞状非小细胞肺癌患者采用培美曲塞与铂类双药化疗四个周期,然后使用培美曲塞进行维持治疗;鳞状非小细胞肺癌患者分别使用紫杉醇与铂类的双药化疗(作为A队列)和吉西他滨与铂类的双药化疗(作为B队列);小细胞肺癌的患者采用依托泊苷与铂类的双药化疗。研究评估了以上患者接受治疗后的疗效、安全性和耐受性等指标,其中疗效评估以RECIST v1.1为评估标准。肿瘤标记物PD-L1的检测采用VENTANA PD-L1(SP263)进行回顾性检测。
截止到2018年10月15日,共54例患者(中位年龄61岁,74%为男性,72%的男性患者有吸烟史或既往吸烟史,31%的患者肿瘤细胞PD-L1表达≥10%)接受了替雷利珠单抗的治疗,其中24例患者仍在接受治疗。36例患者达到确认的部分缓解,其中大多数患者的PR在前两次评估中即得到确认。49例患者实现疾病控制,总体人群DCR91%。其他的疗效评估例如PFS尚未成熟。安全性方面:发生率>15%的3级及以上AE有:中性粒细胞减少(n=25)和贫血(n=9);而发生例数≥2例患者的irAE包括:三碘甲状腺原氨酸降低、甲状腺功能亢进、甲状腺功能减退和发热(各有2例);鳞状非小细胞肺癌A队列中有1例患者在治疗一个周期后出现致命性的心肌炎/肌炎;其他的不良事件随着替雷利珠单抗治疗的暂停中断(n=30)、停止使用(n=4)或者其他适当处理后而恢复。
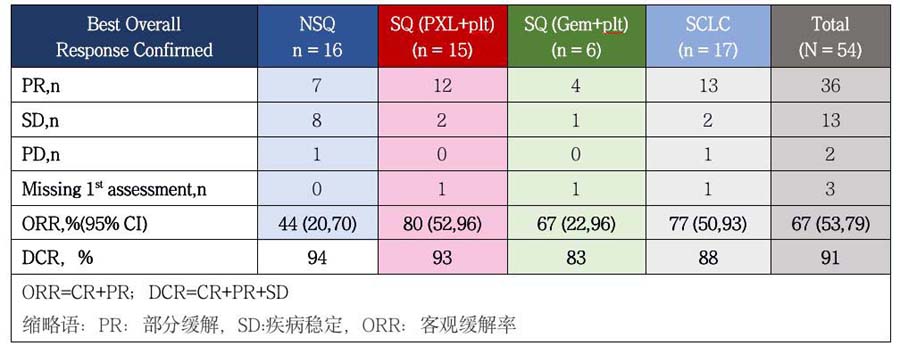
结论:替雷利珠单抗联合传统铂类为基准的标准化疗方案用于中国肺癌患者的一线治疗具有良好的耐受性和抗肿瘤活性。
药厂:
百济神州开发。