相关背景
非小细胞肺癌(NSCLC)是全球最致命、最常见的癌症之一。作为非小细胞腺癌的一个亚型,细支气管肺泡(或支气管肺泡)癌(BAC)较为特殊,对于目前的标准化疗具有独特的应答。根据美国国立综合癌症网络(NCCN)提出的病理评估原则,这类肿瘤的组织学特征是,癌细胞沿着既有的肺泡结构扩散,而不侵袭基质、胸膜或淋巴。根据经典的免疫组化特性描述,“以前的”非黏液性BAC表达甲状腺转录因子1(TTF-1)和CK7而不表达CK20;“以前的”黏液性BAC不表达TTF-1而表达CK7和CK20。美国胸科学会(ATS)已进一步更新了国际多学科分类,后者包含原位腺癌、微浸润性腺癌、浸润性腺癌(包含以前的非黏液性BAC)和浸润性腺癌的变体(包含以前的黏液性BAC)。
实际上,分子靶标已脱颖而出成为对抗NSCLC的主要分层策略,而BAC也随着分类细化而愈发显示出独特性。以前的非黏液性BAC(伴胚层模式)可能更常表现出EGFR突变,而以前的黏液性BAC则通常无这类突变,但二者却都常常含有K-RAS突变。一些研究提示,K-RAS突变可能预示患者能从铂类/长春瑞滨化疗或表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗中获益。据报道,NSCLC腺癌患者中2%~7%存在ALK酪氨酸激酶的基因重排(包括EML4-ALK突变),而且这类肿瘤也对EGFR TKI耐药。综合考虑这些复杂的分子决定因素,为细支气管肺泡癌选择最佳治疗难度颇大。现报告1例早期BAC切除后出现明显疾病进展的老年男性患者,他把我们带到了治疗决策的十字路口前。
病例介绍
患者,男,年龄75岁,曾经轻度吸烟,于2009年因胸部CT扫描结果异常而首次前来就诊。当时CT发现右中肺叶有1枚1.3 cm的结节。在随后的正电子发射断层扫描(PET)中,这枚肿物是唯一的一个FDG高摄取病灶。支气管镜检查未发现支气管内病灶,刷拭加冲洗检测结果均未发现恶性肿瘤细胞。该患者的肺功能符合肺叶切除术的要求,在实施右中肺叶切除术和纵隔淋巴结采样之后,病理学检查显示为3.1×1.5×1.2 cm分化良好性BAC,肺泡型,局灶黏液性和乳突状特征(见图1);所采集的淋巴结均未受累,因此初步判断肿瘤为T2aN0(IB)期。分子特性方面,该肿瘤存在KRAS G12C突变。免疫组化检查显示EGFR表达水平为1+,但为外显子18~21野生型突变。患者在术后与肿瘤内科医生会商,后者建议其接受观察而不需要辅助治疗,采用较短间隔的CT扫描进行监测。
2010年,医生在对比不同时间点CT影像后发现右上肺叶和左下肺叶出现了新的病灶。左下肺叶肿物活检结果证实为浸润性黏液腺癌(以前的黏液性BAC)。再次分子学检测结果显示,仍为同一突变——K-RAS G12C。医生与患者讨论了多种治疗选择,而患者拒绝接受姑息化疗。经过商讨,开始给予厄洛替尼150 mg/d治疗,但患者耐受性不佳,发生了克林霉素凝胶和强力霉素治疗无效的2级皮疹。3个月后,患者自行中止了厄洛替尼治疗,并希望继续接受监测、商讨可能的化疗选择。
2011年,该患者开始出现上背部疼痛。胸部、腹部和盆腔CT扫描显示,已知的右上肺叶肿物已出现进展,且双侧肺内新出现了多枚小结节。右锁骨远端有1处可扩张的溶骨性病灶,右半胸的右脊旁肌软组织内另有2枚肿物。对右脊旁肌软组织内肿物活检也证实为浸润性黏液腺癌。患者开始接受镇痛治疗和地塞米松抗炎治疗。肿瘤放疗科医生对其进行了评估,考虑采取姑息措施,包括对疼痛的脊旁肌和锁骨区域进行外照射放疗。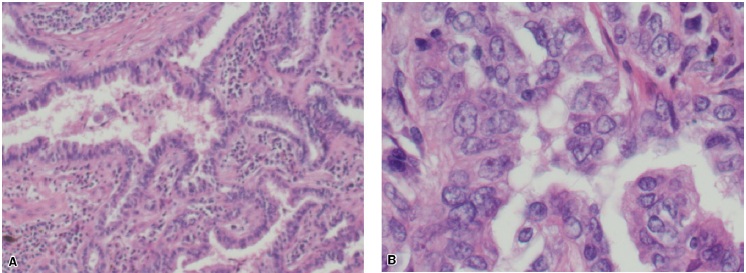
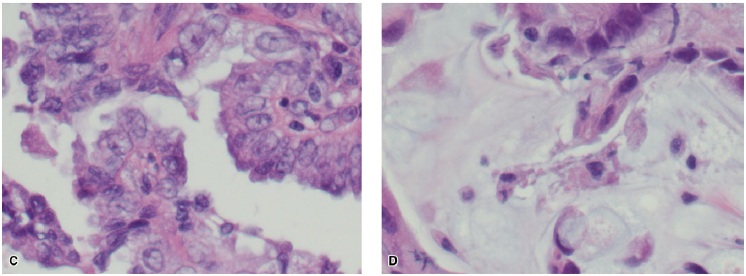
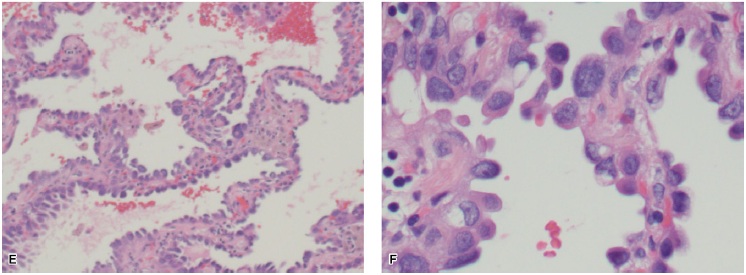
图1. (A)原发肺部肿物活检,可见中至高分化腺癌,并显示出不同大小和形态的腺体,肿瘤腺体之间的基质有慢性炎症细胞浸润。苏木精-伊红染色,放大10倍。(B)原发肺部肿物活检,显示出中至高分化腺癌。苏木精-伊红染色,放大40倍。(C)原发肺部肿物活检,显示出具有乳突状特征的中至高分化腺癌。苏木精-伊红染色,放大40倍。(D)原发肺部肿物活检,显示出中至高分化腺癌和黏液区域。苏木精-伊红染色,放大100倍。(E)原发肺部肿物活检,显示出中至高分化腺癌,可见肿瘤细胞沿肺泡壁走行的支气管肺泡特征。苏木精-伊红染色,放大10倍。(F)原发肺部肿物活检,显示出支气管肺泡特征的中至高分化腺癌。苏木精-伊红染色,放大40倍。
现提出以下问题:(1)你会如何进一步治疗?理由是什么?(2)对于BAC还有哪些其他可选的一线治疗?对于复发性BAC呢?
该患者有经活检证实、含有K-RAS癌基因突变的转移性黏液性BAC。在讨论治疗选择之前,有必要评价肿瘤组织学和突变状态。2008年,在国际肺癌研究协会(IASLC)、美国胸科学会(ATS)和欧洲呼吸学会(ERS)的支持下,一个国际多学科肺癌专家组修订了肺腺癌的子分类,结果黏液性BAC被重命名为浸润性黏液腺癌。有趣的是,一些回顾性研究显示,K-RAS突变在黏液腺癌中更常见。K-RAS基因编码一种三磷酸鸟苷(GTP)酶,后者在细胞增殖、存活和分化中发挥关键作用,并且参与多种癌症的发生。北美肺腺癌患者约25%存在K-RAS突变,而在亚洲患者中则少见得多。与从不吸烟者相比,K-RAS突变在以前/目前吸烟者的肿瘤中更常见,而在肺鳞状细胞癌中较少见。
在本例患者的肿瘤中检测出K-RAS突变对于治疗决策具有重要意义。该患者曾接受厄洛替尼作为转移癌的一线治疗。这种做法是有争议的,因为有多项研究显示,K-RAS突变是患者对EGFR TKI(厄洛替尼和吉非替尼)产生影像学应答的负性预测因素。目前尚无一种直接抗K-RAS治疗被证明对肺癌有效。Salirasib可通过阻断膜结合而预防RAS活化,近期在一项针对K-RAS突变晚期肺腺癌患者的Ⅱ期研究中接受了评估,结果无1例患者产生影像学部分应答。还有一些正在进行中的临床试验,试图评估针对其他通路的靶向药物对这类肺癌患者的疗效,包括热休克蛋白90(HSP-90)抑制剂单药或联合哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂(NCT01427946)和K-ras介导活化细胞外调节(MEK)抑制剂(NCT01362296, NCT01395758)。
目前,对于浸润性黏液腺癌(黏液性BAC)的标准一线治疗与所有其他非鳞状细胞性NSCLC的治疗相似,包含4~6个周期的以铂类为基础的doublet化疗。在可以使用贝伐珠单抗的患者中,应考虑卡铂+紫杉醇+贝伐珠单抗或卡铂+培美曲塞+贝伐珠单抗。值得一提的是,这两种方案都包含化疗4个周期之后的贝伐珠单抗单药或联合培美曲塞维持治疗。这种维持治疗应持续至疾病进展或毒性不可接受。然而,一项非预设的回顾性分析显示,卡铂+紫杉醇+贝伐珠单抗方案与老年(>70岁)患者毒性增加有关,却并不能明显改善总生存率。当然,患者的年龄和体能状态是启动任何治疗之前都必须考虑的。
尽管鉴于多项研究显示K-RAS突变预示对EGFR TKI无影像学应答,我们可能不愿考虑将厄洛替尼作为该患者的一线治疗,但基于与安慰剂相比可使生存期延长2个月,该药已被FDA批准用于非选择性NSCLC患者的二线/三线治疗。
综上所述,根据年龄和体能状态,我们考虑对这例有K-RAS突变的转移性浸润性黏液腺癌(黏液性BAC)患者采取以铂类为基础的doublet化疗,或者让他参加针对具有这一分子特征的患者群的临床试验。这一病例表明,肿瘤样本组织学检查可以为我们了解潜在肿瘤突变状态提供线索,且凸显了NSCLC分子学检查的重要性。此外,这一病例也显示出,了解肺癌的分子学发生机制有助于制定治疗策略。
这一病例阐释了转移性肺腺癌治疗中的多个重要问题。BAC是腺癌的一种亚型,具有一些独特性,包括:分化良好的细胞学,沿肺泡壁的胚层生长模式,以及表现为多灶性肺部病变的倾向。它曾被分为黏液型、非黏液型和混合型。目前,临床医生仍在使用BAC这一术语来描述具有BAC成分的非浸润性“单纯”型和混合型腺癌。然而,IASLC、ATS和ERS于2011年提出了新的腺癌分类,建议停用BAC这一说法,以前所谓的“单纯”BAC将被称为“原位”腺癌(AIS)。AIS是指无任何浸润成分的局限性小病变(<3 cm),相应的5年生存率为100%。假如标本中包含任何浸润成分,例如基质、胸膜或淋巴血管浸润,就应当称之为浸润性腺癌。不过为了便于讨论这一病例,我们还是沿用“BAC”这一名称。
晚期或转移性“BAC”的治疗范式通常是肺腺癌治疗的镜像,原因在于其个性化的分子学和组织学特征。理想情况下,应当在启动针对晚期疾病的治疗之前评估是否存在EGFR突变,并在有条件进行快速分子学检测、靶向治疗和临床试验的情况下检测K-RAS突变状态或间变性淋巴瘤激酶(ALK)融合癌基因。
值得一提的是,EGFR突变状态在BAC中的特异性更高。曾有学者对连续86例患者进行了检测,结果发现26%的患者存在这一突变。有趣的是,所有的EGFR突变都存在于非黏液性BAC患者中(22/69),而黏液性BAC患者无一携带该突变(0/17)。其他综述也支持这一结果。有3项Ⅱ期研究评估了EGFR TKI一线治疗用于晚期BAC患者的疗效,结果应答率介于13%~22%。女性、从不吸烟者、发生皮疹者、非黏液性亚型者和K-RAS野生型肿瘤的应答率较高。
众所周知,EGFR突变的存在与肿瘤对EGFR TKI的敏感性高度相关,而另一方面,越来越多的证据显示K-RAS突变与TKI原发耐药相关。关于K-RAS突变肺癌对以铂类为基础的化疗的敏感性,现有证据并不一致。近期美国临床肿瘤学会(ASCO)发布了对4项大规模辅助化疗研究数据的汇总分析结果,表明与K-RAS野生型患者相比,化疗在更普遍的密码子12突变亚型中的疗效几乎没有变化。
对于本例患者,假设他相对健康且愿意探讨治疗选择,那么就应当讨论以铂类为基础的doublet化疗。过去BAC曾被一些人认为具有化疗抗性,然而多数临床试验显示其应答率与肺腺癌患者相似。2项采用紫杉醇的前瞻性Ⅱ期临床试验显示,客观应答率为54%。尚无前瞻性临床试验评估当前化疗对于BAC患者的作用。或许可以借鉴包含BAC亚型患者的NSCLC试验的数据。
仅凭年龄并不足以放弃doublet化疗,但前提是患者具有良好的体能状态且没有妨碍化疗的合并疾病。化疗选项包括顺铂或卡铂+培美曲塞、紫杉醇、吉西他滨、多西他赛或长春瑞滨。我们个人倾向于对年龄>70岁的患者采用以卡铂为基础的化疗,原因是其毒性更轻。鉴于有数据显示培美曲塞对非鳞状细胞性肺癌的疗效更佳,可将其作为优选药物。假如他不太符合条件,从上述药物中选择一种进行单药化疗也是合理的。
还可考虑在化疗基础上加用一种靶向药物。该患者的初始肿瘤为EGFR表达1+,尽管这是EGFF TKI应答率的不佳预测因素,但符合使用西妥昔单抗(一种EGFR单克隆抗体)的标准。ErbituXD治疗肺癌(FLEX)试验中的一线治疗结果显示,对有一定程度EGFR表达的患者在顺铂+长春瑞滨基础上加用西妥昔单抗可带来一些益处。假如他没有贝伐珠单抗禁忌证,那么在紫杉醇+卡铂基础上加用贝伐珠单抗也是一个选择,因为E4599试验表明这一联合治疗具有生存优势。但对70岁以上患者采取这一联合治疗方案必须谨慎,因为毒性会增加。
综上所述,这是一名年龄75岁、有“BAC”病史、在初步切除后复发、已转移并出现骨骼病灶症状、肺内病灶已发生进展的男性患者。由于已出现症状,他现在可能比以前更愿意接受化疗了。不论化疗方案是什么,他都应当接受最佳支持治疗,包括镇痛和对症治疗,以及痛性骨骼病变放疗。我们认为,适用于任何非鳞状细胞性转移性NSCLC并且根据他的体能状态、其他健康问题及倾向性进行了调整的标准化疗方案,将能够使他获益。K-RAS突变状态在某种肿瘤中以及在不同肿瘤中的作用,仍然是一个热门的研究话题;目前尚无充分证据支持基于K-RAS突变状态否定以铂类为基础的化疗的做法。
这是一名黏液性BAC患者,因早期肿瘤接受了切除术并开始接受观察,后出现疾病复发和转移性进展,尽管存在K-RAS突变仍选择TKI治疗。
多位肿瘤内科专家已经围绕这例患者的治疗选择提出了各自的意见。历史上,BAC曾被描述为对化疗应答率较低的肿瘤。但Laskin等人指出,早期的小规模Ⅱ期研究显示,BAC或有BAC特征的腺癌对TKI类药物厄洛替尼、吉非替尼有较高的应答率,而且毒性通常可耐受。然而,Miller等人不久前报告,携带EGFR突变的患者的应答率为83%,中位生存期为23个月,但厄洛替尼对K-RAS突变阳性患者的疗效微不足道,总应答率仅为22%;免疫组化检查所示EGFR表达情况与较高的应答率或无进展生存率(PFS)无关。不过,厄洛替尼已被用于NSCLC维持治疗,通常用于表达野生型EGFR的患者。因此,BAC的治疗方式也相应发生了变化。
K-RAS突变作为应答率(通常是接受了单纯化疗的Ⅳ期NSCLC患者)预测因素的价值尚未被充分理解。然而,有学者对评估特罗凯联合紫杉醇和卡铂的应答率的Ⅲ期试验/盐酸厄洛替尼OSI-774联合卡铂和紫杉醇治疗晚期NSCLC(TRIBUTE)试验的数据进行了分子学分析。在这项试验中,未曾治疗的NSCLC患者接受化疗+安慰剂或化疗+厄洛替尼治疗。结果显示,携带K-RAS突变者对厄洛替尼+卡铂+紫杉醇的应答率实际上低于仅接受双联化疗者(8% vs. 23%),总生存率危险比(HR)为2.1;接受厄洛替尼+化疗治疗的K-RAS突变患者总生存期最短。
该患者在发生进展时却接受了姑息治疗。医生采用三野技术对T8~L1进行了缓解疼痛的局部放疗,总剂量为3,000 cGy,分10次完成。不幸的是,该患者还发生了脑转移,并在进入临终关怀之前接受了3,500 cGy/14次的全脑照射,每次采用侧向对穿照射给予250 cGy。我们询问了,BAC的哪些其他分子和表型因素可影响该患者的治疗干预。
我们提供了挽救治疗。正如Noonan博士和Laskin博士所指出的,西妥昔单抗——一种针对EGFR的嵌合单克隆抗体,联合化疗治疗晚期NSCLC有轻度活性和生存益处——已在Ⅱ期研究中对携带K-RAS突变的晚期BAC患者显示出轻度效果(应答率7%,疾病稳定率35%,每6例EGFR突变患者和每7例K-RAS突变患者中可产生1例部分应答)。基于这一结果,西妥昔单抗联合化疗成为了该患者的一种治疗选择。
然而,假如能更好地理解该患者肺癌的亚型,我们就可能提供更精准、更个体化的建议。正如Horn博士、Reckamp博士和Laskin博士所说的,BAC的新病理学分类根据组织学侵袭性将该病分层,已有学者报告了更深入的组织学危险分层,更特异的模式向我们展示了独立于分期和治疗的总生存、疾病特异性生存、无病生存预测因素。这些应成为综合性临床、形态学和分子学分型的一部分,从而更好地指导治疗。此外,microRNA目前已可在病理学难以鉴别鳞状细胞癌和非鳞状细胞癌时发挥作用;然而,现在我们应当更关注如何利用该技术对BAC进行分型,以确定预后、预测应答以及判断治疗干预的分子靶点。
重要的是,K-RAS突变的类型可能影响患者的危险分层。与其他突变类型及野生型K-RAS突变相比,Gly12Cys或Gly12Val替代型具有更差的PFS。此外,Lovly博士和Horn博士还讨论了针对其他分子通路、正在进行中的临床试验。新的病理学分类是否会影响该患者的早期危险分层和预后,仍是值得商榷的问题。实际上,再次活检是指导临床决策的重要工具。
患者拒绝标准化疗的建议以及进一步的个体化治疗选择,对于肿瘤内科医生而言无疑是个挑战。欢迎各位读者参与讨论和发表意见。