贫血是指外周血中单位容积内红细胞(RBC)数量减少或血红蛋白(HGB)浓度减低。
导致淋巴瘤贫血的原因很多,如淋巴瘤合并出血、溶血、遗传性疾病、肾功能不全、营 养缺乏(缺铁、叶酸或维生素B12缺乏)、慢性病等,常为综合因素所致。肿瘤本身可以通 过各种途径导致或加重贫血的发生。肿瘤细胞通过骨髓侵犯直接抑制血细胞生成,还可产生 一些炎性细胞因子导致和加重贫血。由于以上多种原因,很多患者在诊断淋巴瘤时就发现合 并贫血。另外,化疗和放疗导致的骨髓抑制也是引起治疗相关的淋巴瘤贫血的主要原因。
初治淋巴瘤患者,如HGB〈11g/dl, 或HGB较基线水平下降超过2g/dl或更多,就需要对贫血的原因进行评估。
血液学检查包括:血常规,大便常规+潜血, 尿常规, 血生化(肝肾功能及胆红素检查), 网织红细胞,铁蛋白,血清铁,总铁结合力,不饱和铁结合力,转铁蛋白,维生素B12,叶酸, 溶血检查(coombs试验等)及骨髓检查等。
病因 | 表现 |
缺铁 | 转铁蛋白饱和度<15%,铁蛋白<30ng/ml |
B12. 叶酸缺乏 | B12或叶酸水平低下 |
出血 | 便潜血阳性或内镜发现出血 |
溶血 | Coombs试验阳性,结合珠蛋白水平低下,间接 胆红素升高, 网织红细胞升高 |
肾性疾病 | GFR<60ml/min/1.73m2,EPO水平低下 |
放疗相关 | 骨髓抑制 |
根据病史、体检及实验室相关检查筛查肿瘤贫血的原因,除去引起贫血的以上一些特定原因, 就应该考虑到肿瘤相关的炎症或骨髓抑制所导致的贫血。
按照贫血的严重程度分级,目前国际上贫血的诊断分级标准主要有两个,分别是美国国立 癌症研究所(NCI)和世界卫生组织(WHO)贫血分级标准。欧美国家大多采用 NCI 贫血分级标准。两者的主要区别在于对轻中度贫血的分级上略有差别。国内也根据临床实践和治疗方法进行了分类(表 2)。指南基本上采用 NCI 分类方式。
级别 | NCI(Hb g/dl) | WHO(Hb g/dl) | 中国(Hb g/dl) |
0级(正常) | 正常值* | ≥ 11 | 正常值* |
1级(轻度) | 10.0~正常值* | 9.5 ~10.9 | 9.1 ~ 正常值* |
2级(中度) | 8.0 ~10.0 | 8.0 ~ 9.4 | 6.1 ~ 9.0 |
3级(重度) | 6.5 ~7.9 | 6.5 ~ 7.9 | 3.1 ~ 6.0 |
4级(极重度) | < 6.5 | < 6.5 | <3.0 |
注:*男性>12 g/dl,女性>11 g/dl
对于非化疗相关性贫血,需要针对不同的病因相应给予针对性治疗:如为营养性贫血则 给予相应的铁剂或叶酸、维生素B12补充;如为自免溶贫(如无激素禁忌)刚给予皮质激素 治疗;如为淋巴瘤侵犯骨髓导致贫血,则针对原发病治疗。而对于肿瘤相关的炎症或化疗导 致的骨髓抑制,则需要根据个体情况评估治疗的风险与获益,从而决定是否给予输血治疗或给予红细胞生成刺激因子(ESAs)。
红细胞输注的主要作用为能够很快地升高HGB和红细胞压积(HCT),如果患者没有活动性出血,1单位(300cc)红细胞的输注能够使HGB升高1g/dl,或者HCT升高3%。我国输血法要求HGB<6g/dl需要给予红细胞输注。国内输血适应证共识:重度及以上的贫血患者; 中度并伴随有严重症状的,需立即纠正血红蛋白值的患者;以往使用EPO无效的患者。根据贫血病情的急缓、轻重、持续时间、是否有缺氧症状、合并症及高危因素等来决定是否给予红细胞输注。
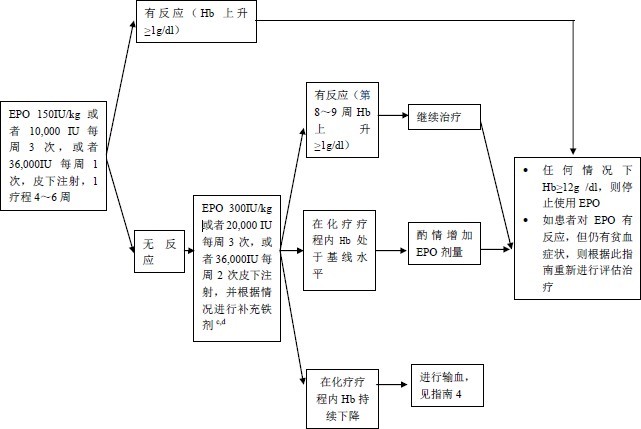
常用的重组人促红细胞生成素(rhEPO)制剂有3种: epoetin alfa (rhEPO)、epoetin beta(一种含糖基化和唾液酸的糖蛋白)和darbepoetin(epoetin alfa的长效衍生物)。这3种EPO中的后两种亦可称为EPO类似物,均含有与人内源性EPO相同的氨基酸序列,与epoetin alfa一样有效。与输血不同,ESAs不能迅速提高HGB的水平,需要几周的时间刺激HGB的反应,但是通过反复注射使用,它能够有效地维持HGB在一个合适的目标水平。
(2)注意事项
如果考虑应用ESAs,需要评估血栓形成的危险因素:既往有血栓栓塞病史、可遗传的突变、高凝状态、化疗前血小板水平升高、高血压、甾类的药物、制动时间延长或限制活动、 最近的手术、针对多发性骨髓瘤的治疗(如反应停等)、激素类药物(hormonal agent)的应用等。
在ESAs应用前必需对各种贫血原因进行检查评估,并给予相应治疗。淋巴瘤化疗导致
的贫血,建议HGB≤10g/dl可根据情况考虑给予ESAs治疗;为了减少ESAs的副作用,在避免输血并有效升高HGB的基础上尽量给予最低剂量的ESAs;如果HGB在2周内升高超过1g/dl, 或者HGB达到不需要输血的水平,则可考虑EPO剂量减量;6-8周的ESAs治疗后如果仍无治疗反应(HGB升高1-2g/dl),则应该停用ESAs;在最后1周期的化疗停止后6~8周,ESAs 需停止使用;使用ESA类药物要把HGB目标值控制在10-12g/dl;由于有随机对照研究报道了
ESAs有引起肿瘤生长的可能,因此对于早期的能够治愈的肿瘤,NCCN不推荐ESAs治疗。
如果为真正的缺铁性贫血(转铁蛋白饱和度<15%, 血清铁蛋白<30ng/mL),则可以单独给予口服铁或静脉铁治疗,而不需要同时使用ESA。而静脉铁在功能性缺铁(铁蛋白
≤800ng/mL,转铁蛋白饱和度〈20%)患者中单用尚未见相关报道。因此目前推荐在化疗诱 导贫血并且合并功能性缺铁的肿瘤患者中给ESAs与静脉铁合用以促进红系统造血。推荐副作用较少的低分子量右旋糖酐铁、葡萄糖酸铁或蔗糖铁。
尽管各家文献报道结果不一存在争论,考虑到静脉铁剂可能促进炎症反应和细菌生长, 因此在有活动性感染的患者中不推荐铁剂的补充。

在NCCN指南中,推荐静脉铁剂在真正缺铁(铁蛋白〈30ng/mL并且转铁蛋白饱和度
〈15% )肿瘤患者中单独使用(不合用ESA)以补充铁的不足,而静脉铁在功能性缺铁(铁蛋白≤800ng/mL,转铁蛋白饱和度〈20%)患者中单用尚未见相关报道。因此目前推荐在化疗诱导贫血并且合并功能性缺铁的肿瘤患者中给予ESAs与静脉铁合用以促进红系统造血。常规剂量的胃肠外铁的不良反应包括:低血压、恶心、呕吐和/或腹泻、疼痛、高血压、呼吸困难、瘙痒症、头痛和头晕。很多与右旋糖酐铁相关的不良反应都是与高分子量右旋糖酐铁有关,而大家推荐的是副作用较少的低分子量右旋糖酐铁、葡萄糖酸铁或蔗糖铁。铁的补充可以给予口服铁或静脉铁,但很多试验都表明联合ESAs使用时,静脉铁疗效好于口服铁。
对于治疗前发生的贫血,应积极寻找原因,针对病因治疗;对于炎症因子或化疗相关性 贫血,在使用ESA类药物、输血或铁剂前要评估这些治疗带来的风险和对病人的利益进行适 当的选择。