2.1 发生机理
MET基因位于染色体7q31,编码分子为190KD的跨膜糖蛋白,属酪氨酸激酶生长因子受体家族成员,其蛋白产物为肝细胞生长因子受体(HGF),与细胞的增殖能力有关。研究显示MET基因扩增能激活ErbB3/PI3K/AKT信号途径,引发对EGFR激酶抑制剂的耐药性。2007年Engelman 等在其建立的吉非替尼耐药的细胞系中检测到MET基因的扩增,并通过对MET信号通路的阻断恢复对吉非替尼的敏感性。在其检测的18例对吉非替尼或厄洛替尼耐药的NSCLC标本中,有4例(22%)检测到了MET基因的扩增;有8例患者在服用靶向药 物治疗前后均检测了MET扩增情况,其中2例疗前无MET基因扩增的患者在接受靶向治疗后出现扩增;有1例对TKI继发耐药患者同时检测到MET基因扩增及T790M突变,另1例患者在不同转移灶中分别检测到T790M突变及MET基因扩增。另有报道,20%NSCLC TKI耐药与c-MET基因扩增有关,其发生与T790M的存在无相关性,通过抑制MET基因的扩增,可以使肺癌靶向治疗的有效率从71%提高到93%。
吴一龙等获得55例术后非小细胞肺癌(NSCLC)的肿瘤组织(基线组)以及23例对TKIs耐药的肿瘤组织(耐药组)后,通过激光显微切割筛选癌细胞后提取基因组DNA,实时荧光定量PCR TaqMan探针法检测所有标本的c-MET基因的拷贝数。结果:1.基线组和耐药组的临床病理特征均与c-MET基因的扩增无关。2.基线组中c-MET基因扩增阳性率为5.5% (3/55);耐药组的c-MET基因扩增阳性率为21.7% (5/23)。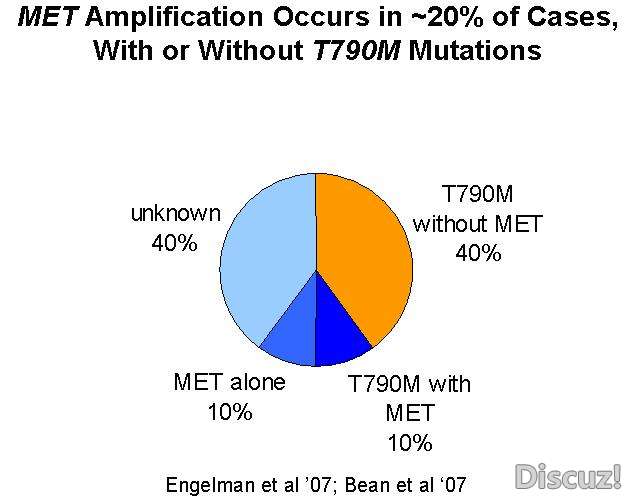
MET是人蛋白激酶家族中的多能受体酪氨酸激酶,它通过自身特异性天然配体肝细胞生长因子(HGF)被激活。MET信号在胚胎形成和早期发育中扮演着重要的生理角色。然而,在成人组织中静息信号状态被异常激活后,会导致细胞大量的增殖、存活、播散、运动和迁移,在肿瘤的发生和肿瘤进展中会导致血管再生、侵袭和转移。有研究显示,MET通路在包括肺癌在内的很多实体瘤及血液系统恶性肿瘤中被激活,并能通过配体或受体的过度表达、基因扩增、MET基因突变以及选择性剪接的方式改变。MET信号通路在治疗人类癌症上已被认为是一个重要的新靶点。众多以 MET/HGF通路为靶点的新型制剂已在一些早期的临床试验中显示了一定的前景。以 MET为靶点的Ⅲ期临床试验已在近期启动。
表皮生长因子受体(EGFR)基因突变、间变性淋巴瘤激酶(ALK)基因融合作为非小细胞肺癌(NSCLC)经典的驱动基因,帮助实现了晚期NSCLC的精准治疗,为临床肿瘤学和精准医学(precisionmedicine)树立了光辉的典范,也催生了越来越多的NSCLC驱动基因成为治疗靶点,研究者们不断地探索着晚期NSCLC的精准治疗。
近年来,C-met基因扩增成为常见恶性实体瘤特别是NSCLC精准治疗的研究热点,但是,它能否像EGFR基因突变、ALK基因融合一样,成为NSCLC的驱动基因而实现晚期NSCLC的精准治疗呢?让我们一同瞩目2014美国临床肿瘤学会(ASCO)年会报告中,晚期NSCLC等实体瘤肝细胞生长因子(HGF)/c-MET信号通路的研究进展。
c-MET基因扩增能否作为驱动基因实现晚期NSCLC的精准治疗?
研究1厄洛替尼±onartuzumab应用于经治ⅢB~Ⅳ期NSCLC:重要的Ⅲ期随机多中心安慰剂对照全球研究METLung(OAM4971g)结果(摘要号8000)
2012年1月至2013年8月该研究入组了499例符合条件的MET免疫组化(IHC)阳性患者,主要终点为总生存(OS)期。
结果显示,厄洛替尼联合onartuzumab不能改善OS期[6.8个月对9.1个月,风险比(HR)=1.27,P=0.06]、无进展生存(PFS)期(2.7个月对2.6个月,HR=0.99,P=0.92)及总有效率(8.4%对9.6%,P=0.63)。
联合治疗组最常见的不良事件为周围性水肿、低蛋白血症、背痛、气促、恶心、痤疮样皮炎和皮疹。该Ⅲ期试验没有验证Ⅱ期研究的疗效结果。独立数据评估委员会因此建议终止了无效的试验,分子亚组的探索性分析正在进行中。
点评:尽管Ⅱ期研究取得了阳性结果,但该项Ⅲ期试验遭遇了“滑铁卢”,到底哪里出了问题呢?
首先,设计厄洛替尼与onartuzumab的联合方案,在抗癌机制上不合理。Ⅱ、Ⅲ期试验入组了大量EGFR野生型患者,设计的科学根据来源于BR21研究,显示厄洛替尼在晚期NSCLC二、三线治疗上显著优于安慰剂,欧美和亚洲多数国家临床指南都推荐厄洛替尼作为临床上不加选择晚期NSCLC标准二、三线治疗之一,而多项随机对照研究(TAILOR、DELTA和CTONG0806研究)证实,厄洛替尼这类EGFR酪氨酸激酶抑制剂(TKI)对EGFR野生型患者基本上无效,那么对照组安慰剂+厄洛替尼作为二、三线方案治疗以EGFR野生型占绝大多数的晚期NSCLC显然不科学,甚至违反伦理。研究组应用厄洛替尼联合onartuzumab方案,onartuzumab是c-MET受体的一种人源化单价抗体,目前没有证据显示其单药治疗NSCLC有效。因此,联合方案治疗EGFR野生型占绝大多数的晚期NSCLC也不科学。
第二,本研究采用MET免疫组化(IHC)阳性(中度或重度阳性染色肿瘤细胞数量≥50%)作为入组的主要标准,而METIHC不能准确识别MET基因驱动的肿瘤,需要更精确的标准来定义MET基因的依赖性(参见摘要号11005研究)。
最后,在分子靶向药物的精准治疗时代,设计Ⅱ、Ⅲ期随机对照试验,大都以PFS作为主要终点更为合理,这样可以避免后续治疗的不均衡性造成对OS的影响,本研究以OS作为主要终点,可能也是不太合理的。
当然,对于EGFR突变合并METIHC阳性的小部分患者,onartuzumab+厄洛替尼联合治疗方案似乎有其理论上的依据,我们期待这一分子亚组的具体分析结果。
研究2克唑替尼治疗c-MET扩增晚期NSCLC的疗效与安全性(摘要号8001)
该研究是克唑替尼Ⅰ期试验(NCT00585195)的组成部分,荧光原位杂交(FISH)方法将晚期NSCLC患者的c-MET扩增程度分为3类:MET/CEP7(注:7号染色体着丝粒)比值1.8~2.2为低度扩增,2.2~2.5为中度扩增,≥5为高度扩增。c-MET扩增在NSCLC人群中的发生率为7.4%(59/800),低、中、高度扩增患者的比例分别为3.6%、3.0%和0.8%。c-MET扩增患者口服克唑替尼250mgbid。采用RECIST1.0标准评价肿瘤客观疗效。
结果显示,低、中、高度扩增患者的有效率分别为0、17%和67%。常见的不良事件包括腹泻(50%)、恶心(31%)、呕吐(31%)、周围性水肿(25%)和视觉障碍(25%),大多数不良事件为1度。本研究仍在继续入组中。
研究者认为,c-MET扩增疾病可能代表了一种含新治疗靶点的NSCLC分子亚型,尤其见于吸烟者。克唑替尼治疗中、高度c-MET扩增NSCLC患者取得了临床疗效。克唑替尼250mgbid耐受性良好且不良事件可以处理。
该结果支持对c-MET扩增NSCLC进行克唑替尼治疗的深入研究。MET/CEP7最佳比值与克唑替尼临床获益相关性的研究正在探索进行中。
点评:该研究初步结果显示,中、高度c-MET扩增晚期NSCLC患者克唑替尼的有效率为41.7%,且高度扩增患者优于中度扩增患者。然而中高度c-MET扩增患者的发生率仅为3.8%,比ALK融合的发生率还要低,是否存在比FISH法更敏感的检测c-MET扩增方法,以提高c-MET扩增晚期NSCLC患者接受克唑替尼治疗的人群数量?
与EGFR基因突变和ALK基因融合的故事相类似,对于c-MET扩增NSCLC患者,检测方法有IHC、FISH、聚合酶联反应(PCR)和DNA测序等方法,何者能最佳地预测肿瘤客观疗效和生存期?
此外,本研究是单臂试验,未来的临床试验在一线治疗时克唑替尼必须与含铂双药方案随机对照,二线时必须与单药化疗随机对照。
研究3高度选择的MET口服抑制剂AMG337首次对成人晚期实体瘤的研究(NCT01253707)(摘要号2508)
该研究评价了AMG337的耐受性、安全性、药代动力学和对肿瘤的客观疗效。至2013年10月,接受各剂量组的c-MET过表达、扩增或突变患者共66例,可供疗效评价者45例,其中1例达完全缓解(CR),4例部分缓解(PR),28例疾病稳定(SD),12例疾病进展(PD)。有8例c-MET扩增患者,7例是胃食管癌(1例CR,4例PR,1例SD,1例PD),另1例肾细胞癌患者有PD。研究者认为,AMG337对c-MET扩增亚型的晚期肿瘤有客观疗效。剂量扩增期最大耐受剂量(MTD)至300mg1次/天时入组将达50例患者。
点评:该Ⅰ期试验初步显示了AMG337良好的耐受性与安全性,AMG337对c-MET扩增的晚期胃食管癌有一定的客观肿瘤疗效(71.4%,5/7)。但该研究未能提供c-MET过表达或突变的数据,以及过表达、扩增或突变三者之间的相关性。此外,除胃食管癌外未看到AMG337对其他c-MET扩增性晚期肿瘤特别是NSCLC的疗效。期待扩大入组的更多数据。
综上所述,单纯的METIHC过表达可能不是HGF/c-MET信号通路精准治疗的分子靶点,而c-MET扩增有望作为NSCLC等恶性实体瘤的驱动基因,从而实现HGF/c-MET信号通路的精准治疗,有前景的药物包括克唑替尼和AMG337等口服c-MET抑制剂。然而,关于c-MET的过表达、扩增或突变三者之间的相关性、何者才是客观疗效和生存期的最佳预测因子等问题,仍需要更深入的研究来回答。
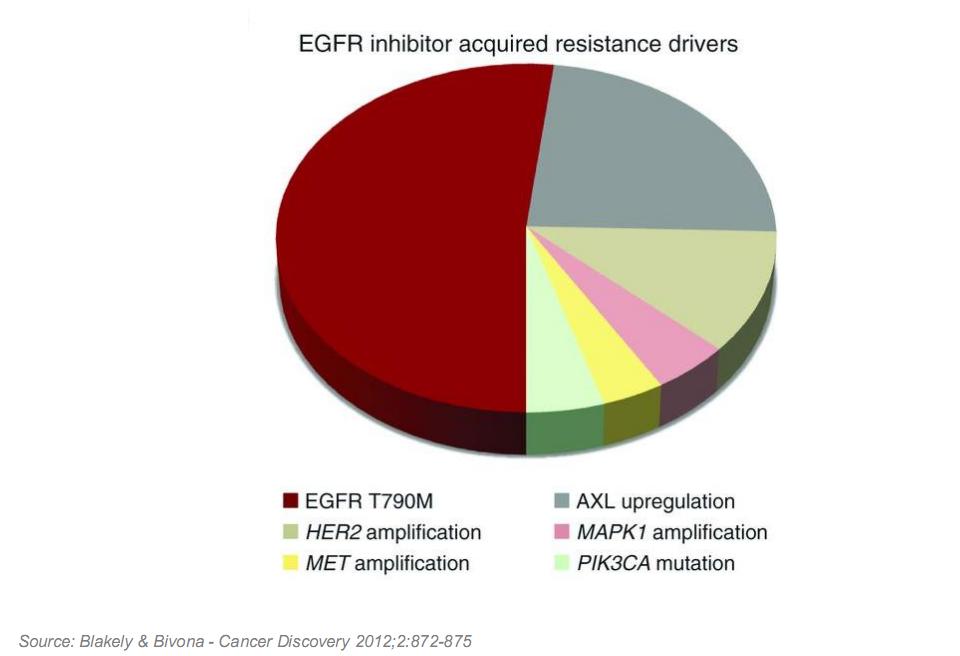
MET基因超表达被认为是晚期非小细胞肺癌(NSCLC)患者表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TIKs)获得性耐药(AR)的常见分子机制。广东省人民医院肺癌研究所的张旭超教授等进行了一项临床研究,对获得性耐药非小细胞肺癌患者MET基因超表达发生率、相关临床病理特点和治疗效果进行探索。
研究通过免疫组织化学(IHC)方法对EGFR TKIs获得性耐药的晚期非小细胞肺癌患者MET基因超表达进行检测。超过50%的肿瘤细胞呈现出中、高度着色,即为MET阳性。MET阳性患者将参加临床试验或接收其他分子靶向治疗。试验过程中同时对EGFR,ALK,KRAS,ROS1基因表达情况进行检测。
2013年1月至2014年1月,研究人员共招募58例吉非替尼或厄洛替尼获得性耐药的晚期非小细胞肺癌患者进行临床试验。
32.8%(19/58)的患者出现MET基因超表达,6.9%(4/58)的患者同时出现MET超表达及EGFR T790突变,29.3%(17/58)的患者出现EGFR T790突变,3.4%(2/58)的患者出现小细胞肺癌或鳞状细胞癌转化,1.7%(1/58)患者出现KRAS基因突变,1.7%(1/58)的患者发生基因融合,而24.1%(14/58)的患者机制不明。
MET 阳性及阴性患者之间临床病理学特征(包括年龄、性别、吸烟情况、身体状况、组织学、临床分期、EGFR突变类型, EGFR TKIs治疗情况),EGFR TKIs响应率 (69.6% 和74.3%),中位无进展生存期(10.6和13.0个月)均无显著差异。
5例MET阳性患者中3例接受吉非替尼联合克唑替尼联合治疗(其中2例部分响应[PR],1例正等待响应评价结果),1例接受克唑替尼治疗(等待响应评估),1例接受阿西替尼治疗(获得部分响应),所有患者均显著临床获益。
研究人员得出结论,MET超表达是EGFR TKIs获得性耐药的常见分子机制,与非小细胞肺癌病理学特征不存在相关性,但可能是吉非替尼、克唑替尼或其它靶向治疗药物的潜在靶点。