韧带样瘤 (desmoid tumor) ,又称侵袭性纤维瘤病( agressive fibromatosis , AF ) ,硬纤维瘤( Desmoid ) 等。是一种由深部筋胆或肌脏膜结构的成纤维细胞及成肌纤维细胞增生而形成的纤维性肿瘤 。
韧带样瘤(desmoid tumor)是由深部结缔组织,主要是肌肉内结缔组织及其被覆的筋膜或腱膜的成纤维细胞及成肌纤维细胞增生而形成的纤维性母细胞性肿瘤,形态上表现良性,但其生物学行为属于低度恶性,呈侵袭性生长,易复发,但不发生转移,又称为侵袭性纤维瘤病、非转移性纤维肉瘤[1]。
韧带样瘤临床较少见,占软组织肿瘤的0.03%。发病率较低,约(0.24~0.43)/10万[2],好发于20~40岁,高发于女性,男女比率约为1:2~5,为育龄期妇女,可发生于全身任何部位,常见于四肢、躯干,发生于腹壁最常见。
病因尚不十分清楚,可能的病因有:
( 1 )创伤因素:多数报告腹壁韧带样瘤发生与创伤有关。
( 2 )遗传因素:韧带样纤维瘤好发生于家族性腺瘤性息肉病患者,两者关系较为突出。其发生率高达8.38%,为一般人群的 2 倍。家族性腺瘤息肉病伴腹壁韧带样纤维瘤、多发性骨瘤、多发性表皮样囊肿等称为Gardner 综合征。
(3) 内分泌因素:本病多见于女性,特别是育龄女性,提示本病与女性激素平衡失调有关。动物实验证实雌激素可诱发此瘤形成,而辜丸酣、孕酣可抑制该肿瘤的发展。
病因尚不明确,基因突变、外伤及性激素失调可能在其发病过程中起重要作用。
韧带样瘤在病理形态上显示正常的有丝分裂,但其元包膜,局部呈侵袭性生长,可侵犯邻近重要结构及脏器,易复发,被认为是一种低度恶性的肿瘤 。
根据发病部位可分为腹壁外、腹壁和腹腔内 3 种类型。
腹壁外型多呈散发性,常见于四肢、肩颈部、骨盆带、胸背部、少数累及颅内、胸腔、乳腺和甲状腺,年轻患者多见,男女发病比例大致相近;
腹壁型多起源于腹直肌或腹内斜肌筋膜和脏膜,女性发病高于男性;
腹腔内型多分布于肠系膜、盆腔及腹膜后,多呈家族聚集性发病。其中以腹壁韧带样瘤最为常见。
腹壁韧带样瘤主要发生在有生育史的育龄女性中,呈侵袭性生长,早期可无临床症状,随着肿瘤增长可出现局部胀痛不适。
CT 表现多样,平扫时病变可呈均匀或不均匀等密度、稍高密度或低密度,增强后病灶可有不同程度的强化。MRI 表现具有特征性,肌肉内占位性病变、相对均质、无坏死、无钙化、无脂肪组织。病灶在T1WI 上呈低信号或等信号,T2WI 病灶均呈高信号,信号强度略低于皮下脂肪。有的病灶内可见到小条状低信号区,与肌肉信号一致,系残存的肌肉岛所致。增强后病灶明显强化,而残存的肌肉岛无强化[4]。MRI还较CT 能精确地显示出病灶内有无脂肪组织,病灶周围是否有水肿区,本病需要与纤维肉瘤、恶性纤维组织细胞瘤、反应性纤维组织增生、脂肪肉瘤等鉴别,根据病史和临床表现一般难以确诊,影像学是其重要的辅助检查,最终确诊还需依靠病理检查。
韧带样瘤的治疗首选手术切除,因该肿瘤有呈浸润性生长、无包膜和易复发的特点,行单纯肿瘤切除的复发率高,应采取肿块局部广泛切除。
本病以手术治疗为主,由于术前确定肿瘤的浸润范围较困难,外科治疗对该肿瘤的切除范围存在争议。外科切除后局部可复发,有研究显示局部复发率可高达40%。因此首次治疗的正确性和尽可能获得病理切缘阴性对局部控制病灶极其重要。药物治疗可预防复发。辅助性放疗可以提高手术治愈率,降低术后复发率。
Micke 等 对切缘状况与肿瘤复发关系作了统计:手术切缘阴性( RO ) ,局部复发率 12%~27% ; 切缘镜下阳性( R1 )患者复发率为 42%~68% ;切缘肉眼阳性( R2 )患者局部复发率为100% 。
手术切除为其首选治疗方法,术中应行扩大切除,以降低术后复发率,形成的腹壁缺损可使用补片修补,有助于避免切口疝的发生及提高患者生活质量。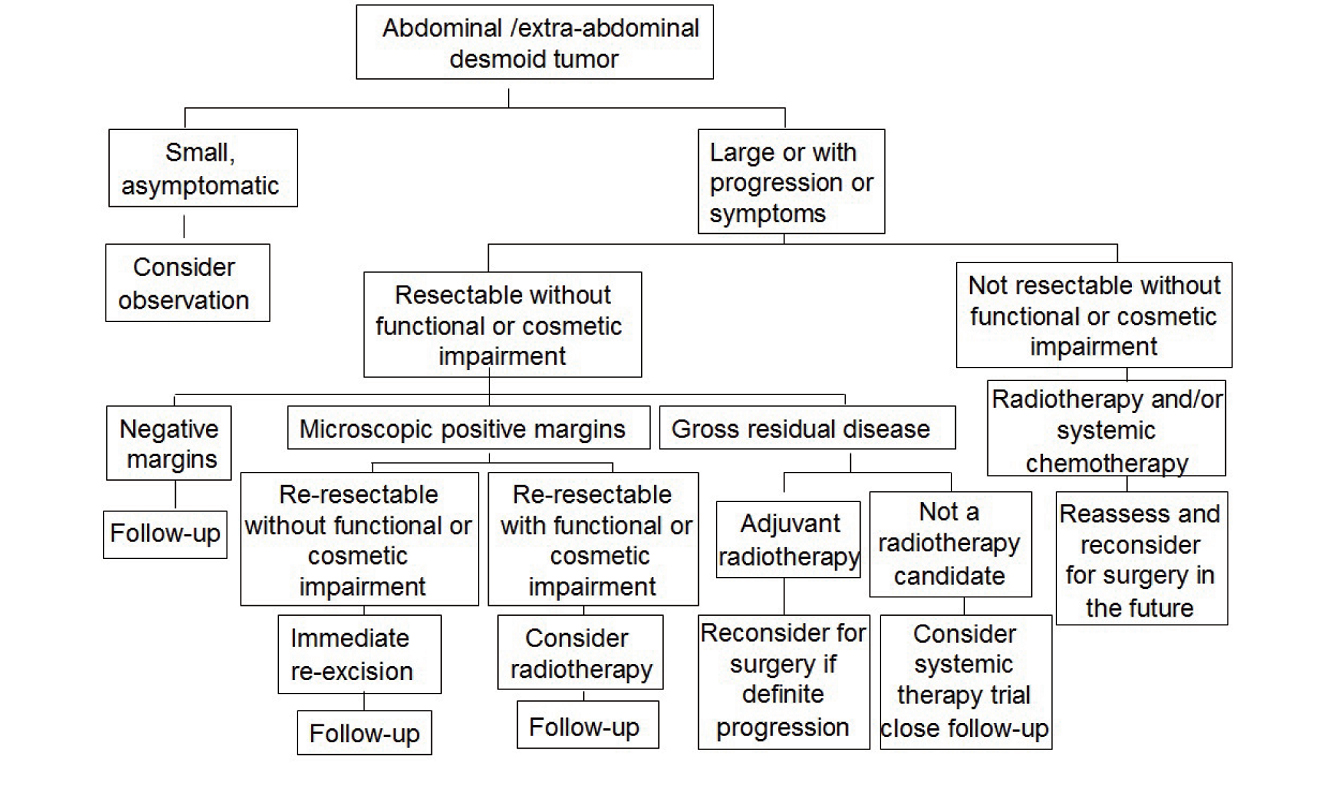
图 1 韧带样瘤的治疗策略示意图
Fig. 1 Multimodality treatment algorithm for abdominal /extra-abdominal desmoid tumor
【参考文献】
1 黄恺,傅红.韧带样瘤的诊治进展及热点问题.中国癌症杂志,2010,20(3):227-231.
2 Papagelopoulos P,Mavrogenis A,Mitsiokapa E,et al.Current trends in the management of extra-abdominal desmoids tumours.World J Surg Oncol,2006,4: 21-28.
3 Kulaylat MN,Karakousis CP,Keaney CM,et al.Desmoid tumour: a pleomorphic lesion.EJSO,1999,25(5): 487-497.
4 卢淮武,林仲秋,刘颖琳.韧带样瘤( desmoid tumor) 诊断与治疗的研究进展.现代妇产科进展,2010,19(11):865-870.
韧带样瘤(desmoid tumor),又称侵袭性纤维瘤病、硬纤维瘤和带状瘤等,是一种由深部筋膜或肌腱膜结构的成纤维细胞及成肌纤维细胞增生而形成的纤维性肿瘤。韧带样瘤在病理形态上无异常核分裂象,但可侵袭性生长,侵犯邻近重要结构及脏器,易复发,所以仍被认为是一种低度恶性的肿瘤。
韧带样瘤临床上较为罕见,发病率较低,约(0.24~0.43)/10万[1]。它可发病于全身任何部位,但常见于四肢,躯干等体表部位。根据发病部位可分为腹壁外、腹壁和腹腔内3种类型。腹壁外型多呈散发性,常见于四肢、肩颈部、骨盆带、胸背部、少数累及颅内、胸腔、乳腺和甲状腺,年轻患者多见,男女发病比例大致相近;腹壁型多起源于腹直肌或腹内斜肌筋膜和腱膜,高发于女性并多见于分娩后数年中;腹腔内型多分布于肠系膜、盆腔及腹膜后,多呈家族聚集性发病。在家族结肠腺瘤息肉病(familial adenomatous polyposis,FAP)患者中,韧带样瘤发病率可高达10%~25%,较一般人群高852倍,而Gardner综合征患者同时发生该病概率可高达29%[2]。
1 病因学及分子遗传学研究进展 韧带样瘤病因至今尚不明确,基因突变、外伤及性激素失调可能在其发病过程中起重要作用[3]。大多数韧带样瘤(>97%)为散发病例,无遗传背景,但也有研究表明遗传性或突变缺陷致结缔组织生长调控异常是此类患者发病可能的原因。家族聚集性病例(亦称FAP相关性韧带样瘤)多见于FAP或Gardner综合征患者,而在此类患者中,目前已有研究证实约15%存在人染色体5q21-22上的腺瘤性多发性息肉病(adenoma-tous polyposis coli,APC)基因突变[4]。
目前认为韧带样瘤形成的分子遗传学机制主要为APC基因失活突变或β-catenin基因激活突变导致核内β-catenin水平上调,Wnt通路被激活,激活下游的靶基因如c-myc、cyclinD1及Cox-2等的转录,引起纤维细胞增殖和分化失控[5];染色体异常如8号染色体三体,20号染色体三体和Y染色体缺失导致肿瘤形成已有报道[6]。
2 早期诊断 韧带样瘤的临床表现多取决于发病的部位。腹壁外型:可表现为偶发、深在的缓慢生长的无痛性肿块,质硬韧、界限不清,压迫、包绕神经时可有麻木、放射性疼痛;腹壁型:多为妊娠后的年轻女性,体检时可发现腹壁肌层有实质性肿块;腹腔内型:早期多无症状,直至压迫浸润周围脏器才出现症状,而此时肿块往往较大。
病史询问时应特别注意3代以内有无结肠多发息肉家族史,或是否行结肠切除,有FAP或Gardner综合征家族史患者,还需行全结肠镜和上消化道内镜检查。年轻患者体检发现深在质硬无痛性肿块,若肿块较小(<5 cm),长期稳定无增大可暂观察;若肿块>5 cm,近期增大明显,有症状或肿块多个,需积极处理,行B超、CT或MRI检查。韧带样瘤多数形态不规则,边缘可见分叶或结节状突起,浸润性生长,无假包膜,境界不清,但坏死少见;少数为膨胀性生长,形态规则,部分境界清楚。MRI诊断价值较高,T1WI多呈等或略高信号,T2WI信号变化多样,多呈不均匀略高信号。而T2WI呈略高信号和肿瘤在各序列中存在低信号致密胶原成分具有重要鉴别诊断价值[7]。
3 外科治疗的热点 韧带样瘤自然病程隐匿,可表现为多种转归。部分患者病情进展迅速,局部浸润明显,即使行广泛切除,10年复发率仍在24%~77%[8-9];也有患者病情长期稳定,不予处理亦可长期稳定甚至自行消退。关于韧带样瘤的研究,国内多为小样本的病例报道,美国安得生肿瘤中心(MD Anderson Cancer Center,MDACC)、纽约纪念斯隆-凯特琳肿瘤中心(Memorial Sloan-kettering Cancer Center,MSKCC)等著名肿瘤中心不乏大宗病例分析,但对其最佳的治疗方案仍颇具争议。
目前,大多数学者认为,外科手术根治性切除仍是腹壁外和腹壁型主要的治疗手段,但对手术指征、复发与切缘关系仍存在争论。目前认为可根治性切除者,首选广泛切除(R0切除)。对于肿块>5 cm、侵犯周围结构、有症状或近期增大明显的患者,建议行积极的手术治疗;而肿块较小,未侵犯周围组织,无症状或肿块稳定患者,可密切随访观察,一旦发现肿块增大,立即手术。
原发的韧带样瘤应强调首次治疗的彻底性,一般认为切缘至少距肿瘤2 cm,甚至切除部分腹膜、肌肉或骨质,以确保切缘阴性;在特殊部位无法保证足够切缘,只要术中冰冻切缘阴性亦可。但也有持反对意见的学者,意大利Gronchi等[10]认为切缘情况不影响原发患者的术后复发,而对复发患者影响较大。MSKCC的Merchant等[11]对189例腹壁外型患者的回顾分析也表明,尚不能证明肉眼观察有残留或光学显微镜下观察有残留会影响无病生存率和总生存率,所以他们建议手术在无法保证切缘阴性时,仍应以保障肢体功能为前提[10,12]。虽然根治性切除保证切缘阴性仍是韧带样瘤外科治疗的标准,但对切缘阳性是否影响复发仍存在争论。所以可根治性切除时应该广泛切除达切缘阴性,无法根治性切除或根治性切除可能带来功能的破坏时,应以保障局部功能为前提,而不必过分追求切缘阴性。
4 腹壁韧带样瘤广切后缺损的修补 腹壁韧带样瘤多发于21~40岁女性,妊娠后多见。起源于腹直肌或腹内斜肌被覆筋膜、腱膜或深部结缔组织。常表现为偶发的条索状质硬肿块,可进行性增大往深部侵犯腹膜,甚至腹盆腔脏器。
外科手术广泛切除是治疗腹壁韧带样瘤的主要方法。手术范围应包括肿瘤边缘至少2 cm的正常腱膜、腹直肌鞘、诸肌肉和筋膜组织,侵犯腹膜可行腹膜切除,最好术中冰冻确保四周和基底切缘阴性。广泛切除后,若腹壁缺损较小可直接缝合加固,若缺损较大或腹膜切除,可用合成补片或肌皮瓣修复[13-14]。黄惠兴[15]报道了11例腹壁韧带样瘤患者肿瘤最大约12 cm,采用肿瘤广泛切除,Dacron补片修复。术后伤口均一期愈合,随访时间3个月~5年,无切口疝和肿瘤复发。笔者收集了近10年中手术治疗的20余例胸腹壁韧带样瘤患者的临床资料,均行切缘>2 cm的广泛切除加涤纶片修复的方法,术中冰冻切缘阴性,切口均一期愈合,无并发症,无肿瘤复发。
5 放疗的疗效及效果 放疗在腹壁外型韧带样瘤治疗中的地位已逐渐得到肯定,主要用于无法切除、切除不完全、切缘阳性或切缘较近的患者。术后辅助放疗能提高手术的治愈率,减少复发,尤其对切缘阳性的患者,经放疗后可达到切缘阴性的效果。Jelinek等[16]比较了单纯手术与手术联合辅助放疗的效果,19例单纯手术患者局部控制率为53%,而35例手术合并辅助放疗患者局部控制率为81%(平均剂量为57 Gy)。Ballo等[17]报道的单纯手术切缘阴性者,10年复发率为27%;切缘阳性者,10年复发率为54%(P=0.003);局部切除后加辅助放疗者,10年复发率为24%,结果表明辅助放疗可降低切缘阳性者的复发率。
放疗也可以作为决定性治疗手段,单独运用于肿瘤巨大或接近重要神经和血管等丧失手术机会的患者,其不仅能有效控制肿瘤进展,而且能促进大部分肿瘤部分或完全消 退[12,17]。Nuyttens等[18]对102例无法手术的韧带样瘤患者行单纯放疗,局控率为78%。Ballo等[17]报道了21例患者行单纯放疗,10年局控率为76%,而手术加放疗10年局控率为75%,单纯放疗取得与手术相当的效果。
放疗外照射的总剂量多推荐50~60 Gy,每次照射剂量为1.8~2 Gy,同时放疗面积要充分,尽可能覆盖肿瘤全部[16],放疗边缘距肿瘤5~8 cm,至少应当包括手术瘢痕[17]。但放疗后肿瘤消退缓慢,完全缓解可能需2年。6 药物治疗进展 目前韧带样瘤的治疗药物主要包括传统的非细胞毒性的非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)类药物(舒林酸或吲哚美辛等)、抗雌激素类药物(三苯氧胺等)、细胞毒性化疗(多柔比星为主方案)以及一些新型的治疗药物如干扰素-α及伊马替尼等。舒林酸、吲哚美辛和三苯氧胺等可用于术前,也可用于术后辅助治疗,特别是有复发风险或进展期腹腔内韧带样瘤的患者[19-20,22]。由于腹腔内型韧带样瘤手术切除后复发率较高,Hansmann等[21]推荐用大剂量的三苯氧胺和舒林酸作为腹腔内型韧带样瘤的一线治疗药物。干扰素-α可用于病灶无法切除或非细胞毒性药物治疗效果不佳的患者[23],但其疗效有待进一步验证。
化疗仅限于非细胞毒性药物治疗失败、肿瘤巨大无法手术切除(如巨结直肠系膜或腹膜后韧带样瘤包绕神经、血管或腹腔脏器)或术后肿瘤有残留的患者。有学者认为化疗在腹腔内型,特别是在FAP相关性韧带样瘤的治疗中,能使肿瘤稳定退缩,避免手术。Gega 等[24]报道了11例FAP相关的,因肿瘤巨大无法手术的腹腔内韧带样瘤患者的治疗方案,96 h持续静脉滴注多柔比星和氮烯米胺,随后口服NSAIDs类药物,结果3例患者完全缓解(complete response,CR),4例部分缓解(partial response,PR),无进展生存期74个月,表明化疗在无法手术或放疗患者的治疗中有一定地位。化疗的方案主要有甲胺蝶呤联合长春碱,多柔比星联合氮烯米胺。以多柔比星为主的方案报道较多,总体缓解率约为50%[20]。
近年来不断有酪氨酸激酶抑制剂伊马替尼用于局部治疗或其他药物治疗无效的进展期韧带样瘤的挽救治疗能使病情稳定或肿瘤退缩的报道[25],美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)和 2007年制定的韧带样瘤诊治规范中亦将伊马替尼列为韧带样瘤的治疗药物,但目前对其作用机制尚不清楚。Mace等[25]对9例韧带样瘤患者进行c-kit及血小板衍生生长因子受体(platelet-derived grouth factor receptor,PDGFR)测定,结果表明均有c-kit及PDGFR阳性表达,但之后陆续报道在韧带样瘤中均未发现c-kit和PDGFR阳性表达,所以目前多数学者认为韧带样瘤为c-kit阴性[26]。Heinrich等[27]报道了19例,其他治疗无效的进展期韧带瘤患者,服用伊马替尼(800 mg/d)后,其中PR 3例,病情稳定(stable disease,SD)4例,该组患者中未发现c-kit、PDGFRA及PDGFRB基因突变,但有PDGFRB蛋白高表达,因此认为伊马替尼的作用可能与抑制PDGFRB激酶活性有关。目前伊马替尼治疗韧带样瘤的报道较少且多用于其他治疗无效的挽救治疗中,其效果有待进一步临床研究。
7 观察等待随访的应用 由于韧带样瘤自然病程多变,药物治疗等疗效多不确切,近来观察等待(wait and see policy)随访的报道也越来越多。Zippel等[28]对患者开始予以三苯氧胺或塞来考昔治疗,观察肿瘤的生物学行为,对于肿瘤保持稳定或缩小的,持续用药1年后停药,如果肿瘤仍生长,给予辅助化疗、手术或放疗。MSKCC的Lewis等[12]报道,对6例需截肢的患者予以观察随访,无一例肿瘤继续进展,3例患者肿瘤略有消退。法国古斯塔夫·鲁西研究所(Institut Gustave Roussy,IGR)肿瘤中心的Bonvalot等[29]研究结果表明对原发患者行R 切除的3年无进展事件生存率(event free survival,EFS)与非手术组患者比较,差异无统计学意义(65%∶68%)。他们认为,若无法行切缘阴性的根治性切除,可保守治疗或观察,而不主张行边缘性切除(R1切除)。
虽然目前对韧带样瘤治疗尚无最佳治疗方案,但根据肿瘤的生物学行为制定的个体化治疗逐渐受到推崇,药物治疗或观察等待治疗也越来越受到重视。综合笔者的临床经验及文献资料,本文概括了韧带样瘤的治疗策略,以供参考(图1)。
图 1 韧带样瘤的治疗策略示意图
Fig. 1 Multimodality treatment algorithm for abdominal /extra-abdominal desmoid tumor
[参 考 文 献]
[1] Papagelopoulos P, Mavrogenis A, Mitsiokapa E, et al. Current trends in the management of extra-abdominal desmoid tumours[J]. World J Surg Oncol, 2006, 4: 21-28.
[2] Sturt NJ, Clark SK. Current ideas in desmoid tumors [J]. Familial Cancer, 2006, 5(2): 275-285.
[3] Kulaylat MN, Karakousis CP, Keaney CM, et al. Desmoid tumour: a pleomorphic lesion[J]. EJSO, 1999, 25(5): 487-497.
[4] Kinzler KW, Nilbert MC, Vogelstein B, et al. Identification of a gene located at choromosome 5q21 that is mutated in colorectal cancers[J]. Science, 1991, 251(4999): 1366-1370.
[5] Dempke W, Rie C, Grothey A, et al. Cyclooxygenase-2: a
novel target for cancer chemotherapy[J]. J Cancer Res Clin
Oncol, 2001, 127(7): 411-417.
[6] 杨吉龙, 王坚, 朱雄增. 韧带样型纤维瘤病的病理学和遗传学研究进展[J].中华病理学杂志, 2005, 34(8): 537-539.
[7] 周建军, 周康荣, 曾蒙苏, 等. 韧带样型纤维瘤病的CT和
MR诊断[J]. 中国医学影像技术, 2007, 23(11): 1700-
1702.
[8] Posner MC, Shiu MH, Newsome JL, et al. The desmoid tumor:
not a benign disease [J]. Arch Surg, 1989, 124: 191-196.
[9] Pritchard DJ, Nascimento AG, Petersen IA. Local control of extra-abdominal desmoid tumors [J]. J Bone Joint Surg, 1996, 78(6): 848-854.
[10] Gronchi A, Casali PG, Mariani L, et al. Quality of surgery and outcome in extra-abdominal aggressive fibromatosis: a series of patients surgically treated at a single institution[J]. J Clin Oncol, 2003, 21(7): 1390-1397.
[11] Merchant NB, Lewis JJ, Woodruff JM, et al. Extremity and trunk desomid tumors: a multifactorial analysis of outcome[J]. Cancer, 1999, 86(10): 2045-2052.
[12] Lewis JJ, Boland PJ, Leung DH, et al. The enigma of desmoid
tumors[J]. Ann Surg, 1999, 229(6): 866-872.
[13] Brenner P, Rammel t S. Abdominial wal l and foot reconstruction after extensive desmoid tumor resection with free tissue transfer[J]. Langenbecks Arch Surg, 2002, 386(8): 592-597.
[14] Rohrich RJ, Lowe JB, Hackney FL, et al. An algorithm for abdominal wall reconstruction[J]. Plast Reconstr Surg, 2000, 105(1): 202-216.
[15] 黄惠兴. 腹壁韧带样瘤切除Dacron补片修补11例[J]. 中
国临床医学, 2002, 9(1): 19-22.
[16] Jelinek JA, Stelzer KJ, Conrad E, et al. The efficacy of
radiotherapy as postoperative treatment for desmoid tumors
[J]. Int J Radiat Oncol Biol Phys, 2001, 50(1): 121-125.
[17] Ballo MT, Zagars GK, Pollack Alan, et al. Desmoid tumor:
Prognostic factors and outcome after surgery, radiation therapy,
or combined surgery and radiation therapy[J]. J Clin Oncol,
1999, 17(1): 158-167.
[18] Nuyttens JJ, Rust PF, Thomas CR Jr, et al. Surgery versus
radiation therapy for patients with aggressive fibromatosis or
desmoid tumors: a comparative review of 22 articles[J].
Cancer, 2000, 88(7): 1517-1523.
[19] Latchford AR, Sturt NJH, Neale K, et al. A 10-year review
of surgery for desmoid disease associated with familial
adenomatous polyposis[J]. Brit J Surg, 2006, 93(10): 1258-
1264.
[20] Sakorafas GH, Nissotakis C, Peros G. Abdominal desmoid
tumors[J]. Surg Oncol, 2007, 16(2): 131-142.
[21] Hansmann A, Adolph C, Vogel T, et al. High-dose tamoxifen
and sulindac as first-line treatment for desmoid tumors[J].
Cancer, 2004, 100(3): 612-620.
[22] Church J, Berk T, Boman BM, et al. Staging intra-abdominal
desmoid tumors in familial adenomatous polyposis: a search
for a uniform approach to a troubling disease[J]. Dis Colon
Rectum, 2005, 48(8): 1528-1534.
[23] Hardell L, Breivald M, Hennerdal S, et al. Shrinkage of
desmoid tumor with interferon alfa treatment: a case report
[J]. Cytokines Cell Mol Ther, 2000, 6(3): 155-156.
[24] Gega M, Yanagi H, Yoshikawa R, et al . Successful
chemotherapeutic modality of doxorubicin plus dacarbazine
for the treatment of desmoid tumors in association with familial
adenomatous polyposis[J]. J Clin Oncol, 2006, 24(1): 102-
105.
[25] Mace J, Sybil BJ, Sondak V, et al. Response of extraabdominal
desmoid tumors to therapy with imatinib mesylate[J].
Cancer, 2002, 95(11): 2373-2379.
[26] Lucas DR, Abbadi MA, Tabaczka P, et al. C-kit expression
in desmoid fibromatosis: Comparative immunohistochemical
evaluation of two commercial antibodies[J]. Am J Clin
Pathol, 2003, 119(3): 339-345.
[27] Heinrich MC, Mcarthur GA, Demetri GD, et al. Clinical
and molecular studies of the effect of imatinib on advanced
aggressive fibromatosis[J]. J Clin Oncol, 2006, 24(7):
1195-1203.
[28] Zippel DB, Temple WJ. When is a neoplasm not a neoplasm?
When it is a desmoid [J]. J Surg Oncol, 2007, 95(3): 190-
191.
[29] Bonvalot S, Eldweny H, Haddad V, et al. Extra-abdominal
primary fibromatosis: Aggressive management could be
avoided in a subgroup of patients[J]. EJSO, 2008, 34(4):
462-468.