
2012-04-05
程序性死亡配体1(Programmed Death-Ligand 1,PD-L1)又称CD274或B7-H1,分子量约40kDa,编码基因位于9p24.1,为PD-1(Programmed death1)受体分子的配体,属于I型跨膜蛋白,胞外区含有IgV和IgC样结构域。PD-1主要表达在T细胞、B细胞、树突状细胞、巨噬细胞、肥大细胞、成纤维细胞和间质干细胞等。PD-L1在多种肿瘤细胞表面表达,与肿瘤的免疫逃逸有关。
免疫检查点抑制剂靶向PD-1及其配体PD-L1。
PD-1是由T细胞表达的,并能调节T细胞在外周组织的活化。PD-1有两个配体PD-L1(也称为B7-H1或CD274)和PD-L2(B7-DC或CD273)。这些配体在广泛的免疫效应细胞、抗原提呈细胞和肿瘤细胞中表达。PD-1是通过配体与肿瘤细胞上的PD-L1结合来活化的,可产生一系列的细胞内效应导致T细胞失活并减少增殖。NSCLC治疗的重点是使用PD-L1或PD-1单克隆抗体来阻断PD-1及其配体PD-L1与肿瘤细胞和免疫效应细胞之间的相互作用。
抗PD-L1免疫组化可能是选择非小细胞肺癌患者使用免疫检查点抑制剂更有效的生物标志物,但随着各种治疗方法的发展,每一种都有不同的抗PD-L1免疫组化检测,需要病理学家和肿瘤学家的关注。
对PD-L1阳性测试结果的定义可能不同,这取决于使用何种生物标志物检测。PD-L1表达水平≥50%是一个阳性结果可以一线使用帕姆单抗治疗。
PD-L1与PD-1结合后能够抑制杀伤性T细胞的活性与细胞因子的生成。在正常组织的感染以及炎症反应中,PD-L1与PD-1的相互作用有助于维持免疫反应平衡和避免自身免疫。在肿瘤微环境中,肿瘤细胞表面PD-L1分子与细胞毒性T细胞表面的PD-1分子结合后可抑制细胞毒性T细胞(肿瘤特异性)的活性,甚至诱导其凋亡,进而使肿瘤细胞获得免疫逃逸。
PD-L1与PD-1途径在肿瘤微环境中的免疫抑制作用是目前对肿瘤进行免疫治疗的重要靶点。抗PD-1单抗(如:Nivolumab和Pembrolizumab)和抗PD-L1抗体(如:Atezolizumab、Durvalumab和Avelumab等)可通过阻断PD-L1与PD-1途径修复细胞毒性T细胞对肿瘤细胞的免疫反应性,进而达到抗肿瘤和提高患者存活的目的。目前多个抗PD-1/PD-L1单抗类药物已获得美国FDA批准上市用于多个肿瘤适应症,如恶性黑色素瘤、非小细胞肺癌(NSCLC)、肾细胞癌、尿路上皮癌、头颈癌、霍奇金淋巴瘤、胃癌、肝细胞肝癌、小细胞肺癌、MSI-H实体瘤等;此外还有大量的以PD-1/PD-L1为靶点的抗体药物正在临床研发阶段。
PD-L1表达是目前抗PD-1/PD-L1治疗较明确的疗效预测因子之一。多个抗PD-1/PD-L1药物临床试验均根据肿瘤细胞+/-免疫细胞中PD-L1表达水平对受试者进行筛选或分层,部分抗PD-1/PD-L1单抗的获批适应症亦以PD-L1的IHC检测作为伴随诊断或补充诊断。
PD-L1 IHC 22C3单抗是Pembrolizumab(KEYTRUDA)多项注册临床试验中采用的唯一伴随诊断用抗体,也是目前FDA批准的唯一一个抗PD-1/PD-L1治疗的伴随诊断用PD-L1抗体,用于NSCLC、胃或胃食管交界处(GEJ)腺癌、宫颈癌、尿路上皮癌中Pembrolizumab适应症筛选。在NSCLC中,以肿瘤比例评分(tumor proportion score, TPS)作为PD-L1蛋白表达水平的评估指标(TPS定义为任何强度的部分或完全膜染色的肿瘤细胞比例),以TPS ≥ 1%为PD-L1表达阳性,TPS ≥ 50%为PD-L1高表达。而在胃或胃食管交界处腺癌、宫颈癌或尿路上皮癌中,则以综合阳性评分(combined positive score, CPS)作为PD-L1蛋白表达水平的评估指标。CPS定义为PD-L1染色细胞(肿瘤细胞、淋巴细胞、巨噬细胞)数量除以评价肿瘤细胞总数再乘以100。在胃或胃食管交界癌、宫颈癌中,CPS ≥ 1判定为PD-L1表达阳性,而在尿路上皮癌中,CPS ≥ 10判定为PD-L1表达阳性。
需要指出的是,基于不同抗体、不同检测平台的PD-L1检测在不同实体瘤、不同抗PD-1/PD-L1药物治疗中的临床诊断应用尚未形成统一意见。纵观多个药物的临床试验数据可以发现:PD-L1表达水平越高,肿瘤患者从抗PD-1/PD-L1治疗中获益的可能性往往越高,但无论判断界值如何定义,都不代表患者可以绝对获益或不获益。因此,对不同肿瘤患者阳性界值的选择,尤其是在PD-L1检测未作为伴随诊断的获批适应症中,应是基于临床获益预测、经济承受能力等多方面综合考量后的选择。
各家临床试验的公布数据显示,PD-L1表达也并非抗PD-1/PD-L1治疗稳定、理想的疗效预测因子,其检测意义仅表现为PD-L1阳性或高表达病例比PD-L1阴性或低表达病例具有更高的客观缓解率。仍有部分PD-L1表达阳性甚至高表达的患者对抗PD-1/PD-L1治疗无效,亦有部分PD-L1表达阴性但对免疫治疗有效。因此,现阶段各大药厂在临床试验中所采用的不同PD-L1检测方法及其判断标准仅仅是人们探索抗PD-1/PD-L1治疗疗效预测因子的第一步,不应僵化为免疫治疗必须和唯一的筛选标准。
在NSCLC中,PD-L1表达越高,包括Pembrolizumab、Atezolizumab和Nivolumab的疗效都更好,其中Pembrolizumab、Atezolizumab治疗OS获益越多,ORR越高。
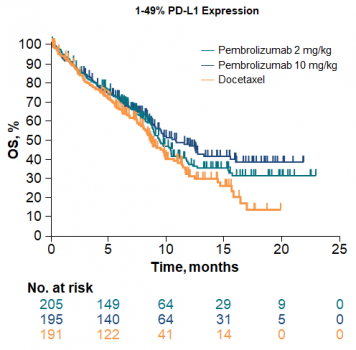
图1. KEYNOTE-010:PD-L1表达越高,Pembrolizumab治疗OS获益越多
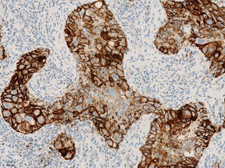
图2. PD-L1在肿瘤细胞(TC)中的表达
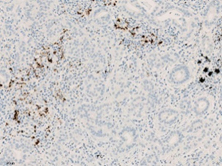
图3. PD-L1在肿瘤浸润免疫细胞(IC)中的表达
TC及IC亚群存在于各(四个)截断值水平*
*TC3 或 IC3 = TC ≥50% 或 IC ≥10% PD-L1+ 细胞;
TC2/3 或 IC2/3 = TC 或 IC ≥5% PD-L1+ 细胞;
TC1/2/3 或 IC1/2/3 = TC 或 IC ≥1% PD-L1+ 细胞;
TC0 及 IC0 = TC and IC < 1% PD-L1+ 细胞,
PD-L1的表达作为预测标志物的不足
免疫反应的调控机制非常复杂,仅凭单一的PD-L1表达作为biomarker仍然不够。
肿瘤异质性——不同瘤种以及同一肿瘤的不同区域
肿瘤病灶和转移灶之间的差异
活检和治疗之间的时间间隔
抗体以及染色情况
有效性的界定(界定值 cut-offs)
表达PD-L1的细胞类型(免疫细胞 vs 肿瘤细胞,或两者皆有)
表达的部位(细胞表面 vs 细胞内膜 vs基质细胞)
强度,多少百分比为“阳性”
分布,斑状 vs 弥漫性, 肿瘤内 vs 肿瘤周围
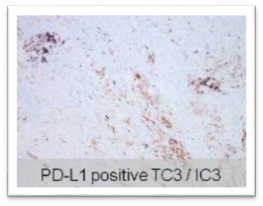
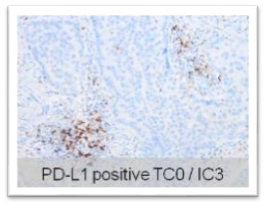
同病灶不同细胞间 PD-L1表达差异显著
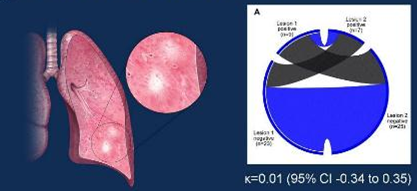
肺部不同病灶间 PD-L1表达差异显著
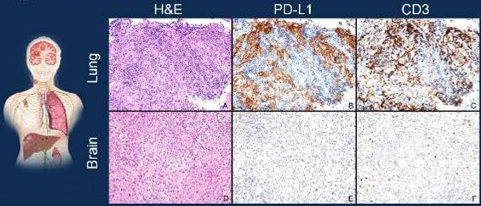
原发灶和转移灶间 PD-L1表达差异显著
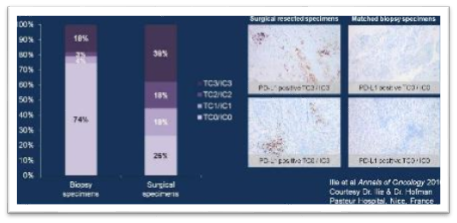
穿刺样本:大量PD-L1假阴性?
【参考文献】
1. Fehrenbacher, et al. Lancet 2016;
2. Gettinger, et al. ASCO 2015
3. Schmid, et al. ECC 2015;
4. Horn, et al. ASCO 2015
5. Hellmann et al ASCO 2016.
6. Borghaei H, et al. The New England journal of medicine 2015;373:1627-39.
7. Brahmer J, et al. The New England journal of medicine 2015;373:123-35.
8. Socinski M et al. Oral presentation at ESMO 2016, LBA7
9. Herbst RS et al. Oral presentation at ESMO Asia 2015.
10. EB Garon at ASCO 2016.
资料来自燃石医学
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)