
2017-10-05
1. 非特异性免疫治疗和辅助免疫治疗
● 细胞因子
● CIK及DC-CIK治疗
● NK细胞治疗
2. 主动免疫治疗
● 肿瘤疫苗:肿瘤疫苗用于肿瘤特异性主动免疫治疗,其效果与疫苗的细胞抗原特异性和免疫原性及宿主的免疫应答反应能力有关。
● 细胞疫苗:肿瘤细胞疫苗;DC疫苗
● 肽疫苗:带有T细胞识别表位的抗原肽
● DNA疫苗:带有肿瘤抗原的表达载体
● 抗独特性抗体疫苗:
3. 被动特异性免疫治疗
● 单克隆抗体(mAb)治疗:
利妥昔单抗(美罗华)是第1个治疗表达CD20的B细胞滤泡性霍奇金病的单克隆抗体。
曲妥珠单抗(赫赛汀,Herceptin)是1997年美国食品药品监督管理局(FDA)通过的用于实体瘤治疗的单克隆抗体。它的治疗作用靶点是乳腺癌过度表达HER2受体。
C225(Cetuximab,Erbitux:以EGFR为靶点治疗肠癌、头颈部恶性肿瘤。
Bevacizumab(Avastin):血管内皮生长因子(VEGF)结合并中和其活性。
4. 免疫活性细胞的过继性免疫治疗
免疫活性细胞的过继性免疫治疗是通过输注抗肿瘤免疫效应细胞的方法,增强肿瘤患者的免疫功能,达到抗肿瘤的目的。
● LAK细胞;
● CIK细胞;
● 肿瘤浸润性淋巴细胞(TIL);
● CD8+T细胞。
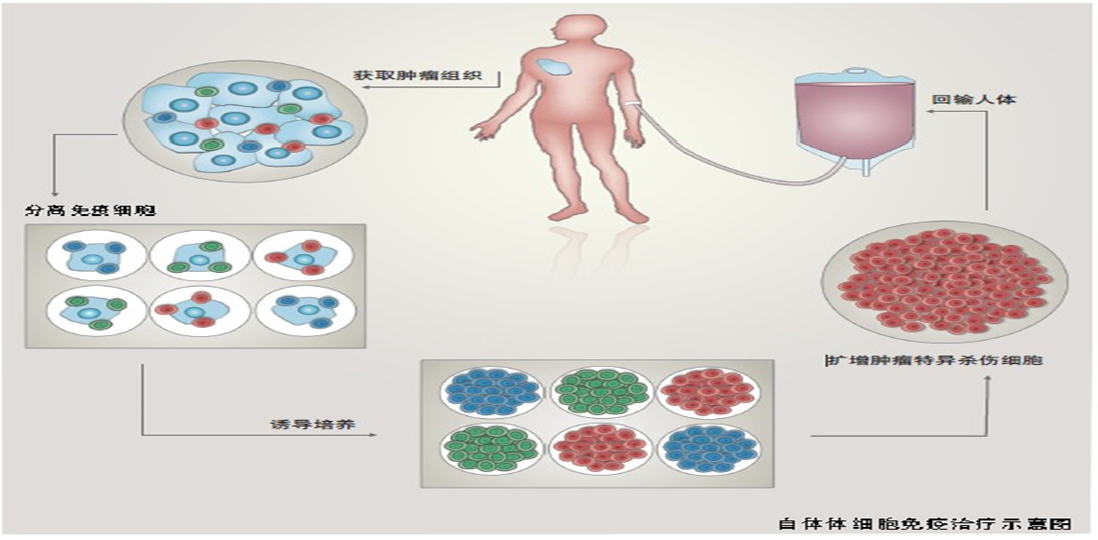
图. 免疫活性细胞的过继性免疫治疗示意图
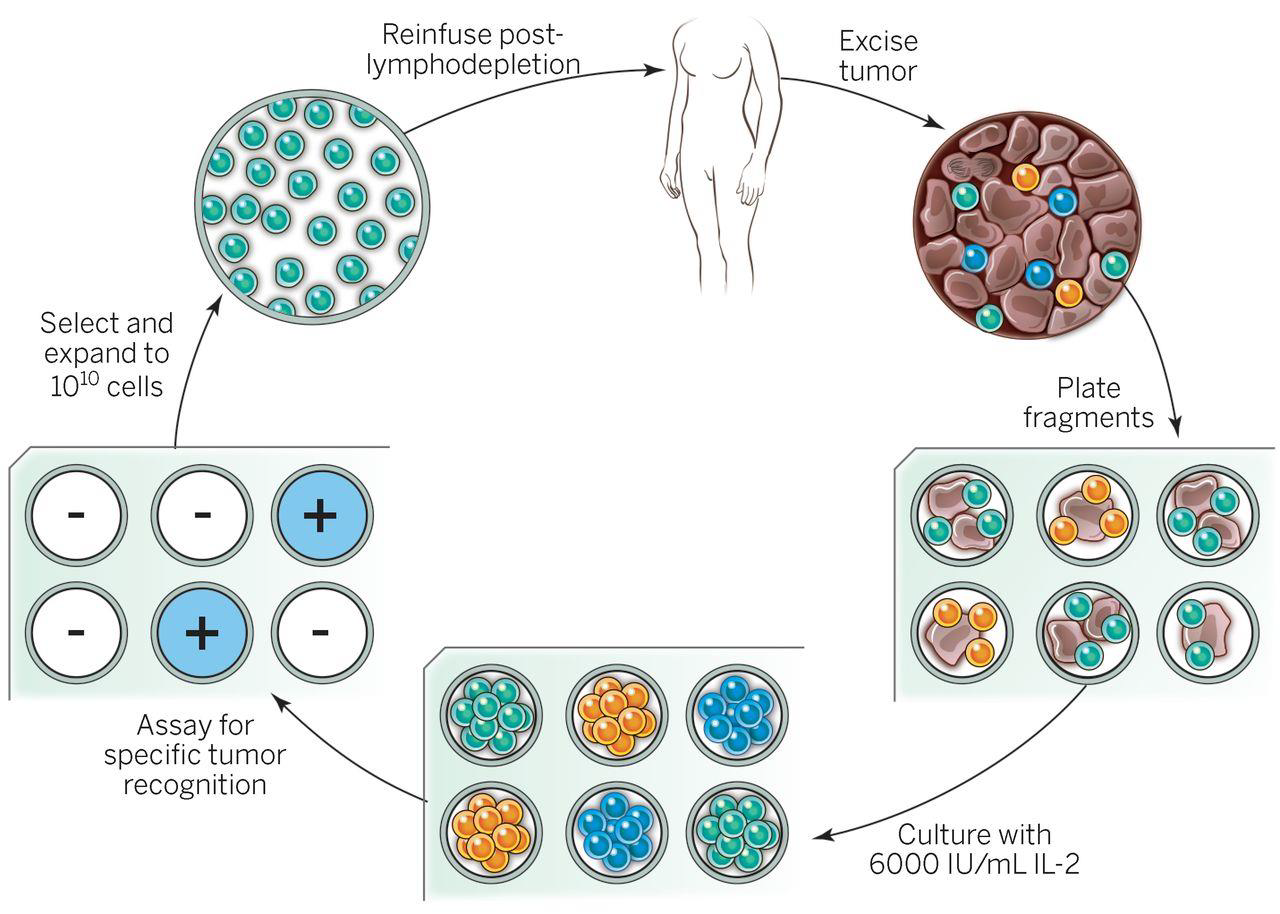
具有能识别肿瘤细胞突变的T细胞患者的治疗示意图
Steven A. Rosenberg, and Nicholas P. Restifo Science 2015;348:62-68
抗原提呈细胞(APC)携带肿瘤抗原制得疫苗
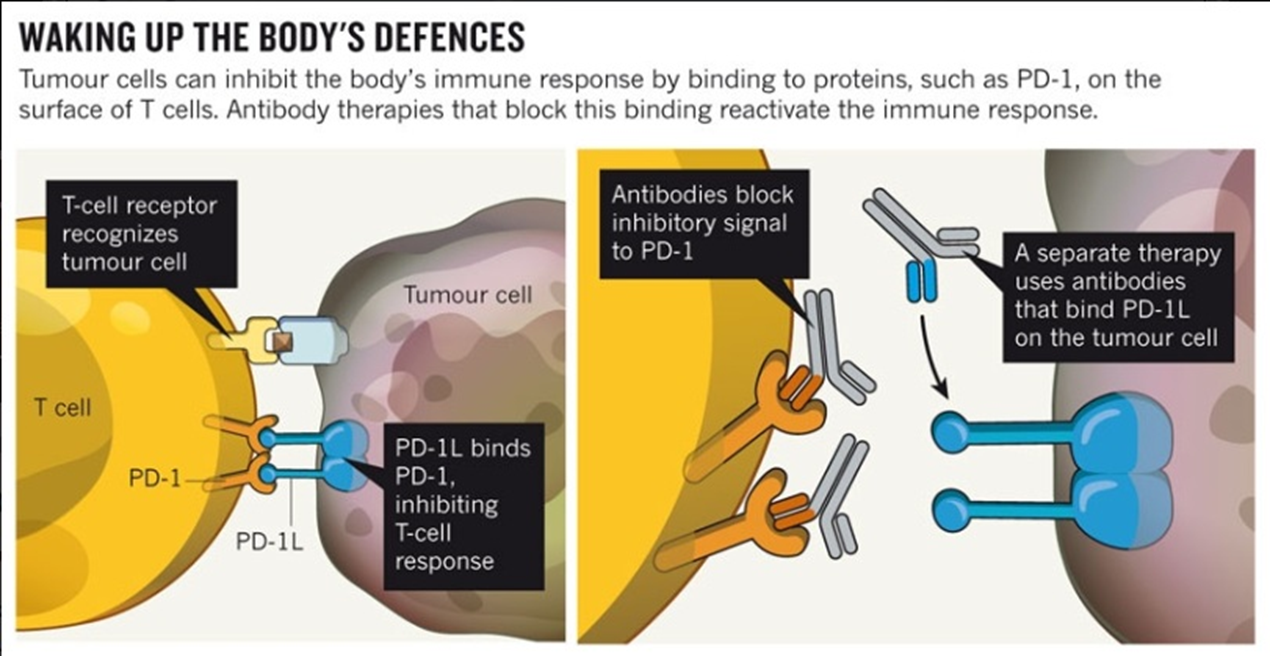
5. 打破肿瘤免疫抑制微环境
● 免疫检查点治疗:阻断免疫抑制信号
● 激活天然免疫系统:局部细菌感染
● 针对肿瘤微环境的TAM及MDSC的治疗
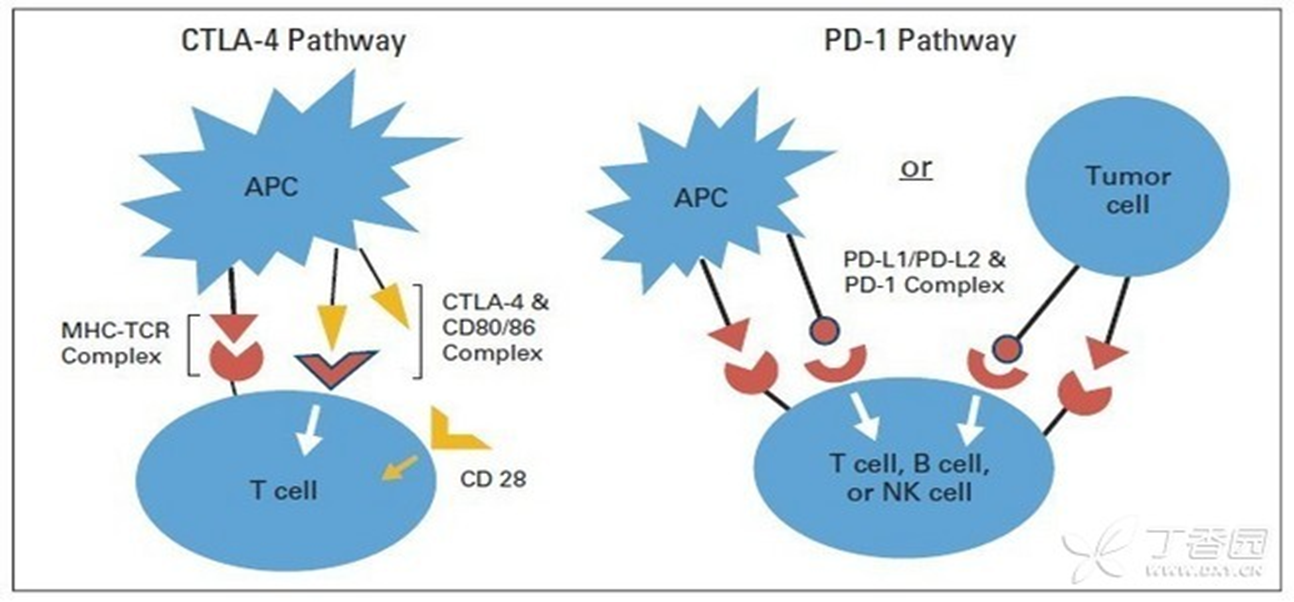
免疫检验点单抗疗法
靶向T细胞活化的免疫信号传导分子
按照双信号理论:
● 第一信号由TCR识别APC表面的抗原肽-MHC复合物(p-MHC)启动;
● 第二信号则依赖T细胞和APC表面共刺激分子的相互作用
共刺激信号(co-stimulatory)B7.1/B7.2/B7H2—CD28、CD137L—CD137、CD70—CD27、CD40—CD40L
共抑制信号(co-inhibitory)B7H1/B7DC—PD1、B7.1/B7.2/B7H2—CTLA4、HVEM—BTLA。
共刺激信号和/或共抑制信号是引导抗原特异性T细胞应答的关键,阻断T细胞活化的共刺激信号或增强共抑制信号,均可负调节T细胞活性,从而诱导T细胞产生免疫耐受或失活。
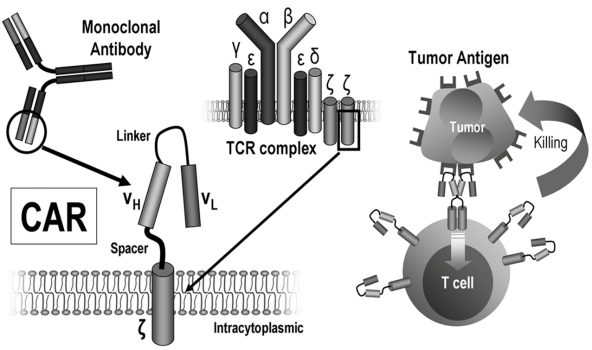
嵌合抗原受体修饰(CAR-T及TCR-T)的T细胞疗法
利用基因工程方法制备的、表达肿瘤特异性嵌合抗原受体(Chimeric antigen receptor,CAR)的T细胞显示出的靶向性、杀伤活性和持久性为过继性细胞免疫治疗。
主要原理是提取肿瘤患者T细胞,通过基因工程嵌入特定的抗原受体,在受体另一端嵌合激活T细胞的元件,并在嵌合蛋白中引入多个共刺激分子,使得T细胞的生存能力、增殖能力、记忆效应增强,使其能识别并攻击病人体内带有该特定抗原的肿瘤细胞,从而达到治疗目的。
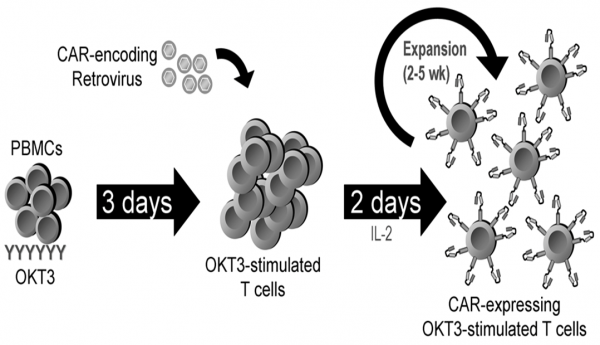
CAR T细胞较其他基于T细胞的治疗方式存在以下优势:
① 使用患者自体细胞,降低排异反应风险;
② 鉴于很多肿瘤细胞表达相同的肿瘤抗原,针对某一种肿瘤抗原的CAR基因构建一旦完成,便可以被广泛利用;
③ CAR既可以利用肿瘤蛋白质抗原,又可利用糖脂类非蛋白质抗原,扩大了肿瘤抗原靶点范围;
④ CAR T细胞作用过程不受MHC的限制;
⑤ CAR T细胞具有免疫记忆功能,可以长期在体内存活。
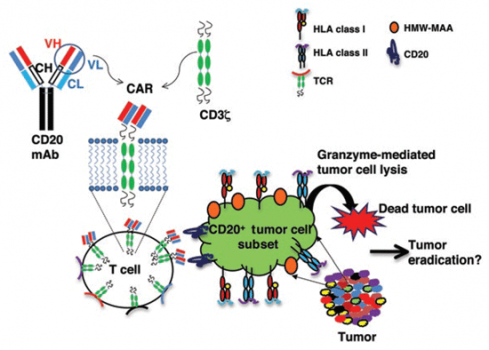
CAR-T杀伤机制
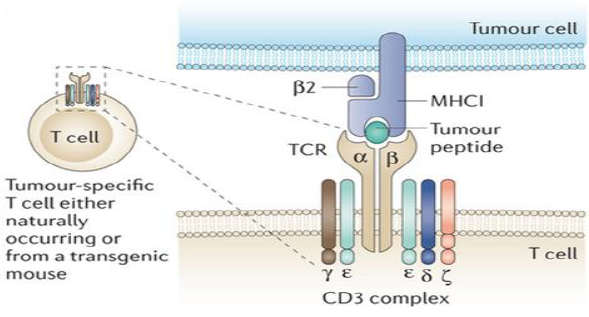
TCR(T细胞受体)-T
校对:小全 2019年11月3日
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)