
2019-05-30
【题目】
[PACIFIC]Durvalumab巩固治疗接受含铂化疗同步放疗后未进展的III期不可切除的NSCLC
【背景】
同步放化疗是目前局部晚期NSCLC的标准治疗方案,中位PFS时间为8~10个月,5年生存率约为15%。
Imfinzi(Durvalumab)是一种人类单克隆抗体,与 PD-L1 结合并阻断 PD-L1 与 PD- 1 和 CD80 的相互作用,抵抗肿瘤的免疫逃避策略,并释放对免疫应答的抑制。
【方案】
探索针对接受含铂化疗同步放疗后未发生疾病进展的III期不可切除的NSCLC患者,接受免疫检查点抑制剂巩固治疗的III期临床试验。该试验共入组713例患者,在完成同步放化疗且达到SD以上疗效之后,以2:1的比例随机接受每两周PD-L1抑制剂Durvalumab 10mg/kg或安慰剂治疗,持续12个月。主要研究终点为无疾病进展生存期(PFS)和总生存期(OS)。
多中心、随机、双盲、安慰剂对照III期临床研究

【资料和方法】
2014 年5 月至2016 年4 月共入组713 名患者,其主要终点是无进展生存期(PFS)和 OS,次要终点包括具有里程碑意义的 PFS 和 OS、总体缓解率和缓解持续时间。
入组人群的基线特征均衡,IIIB期患者,Durvalumab组和安慰剂组的患者比例分别为44.5%和45.1%;同步放化疗后疾病稳定的患者,两组分别为46.6%和48.1%。
【结果】
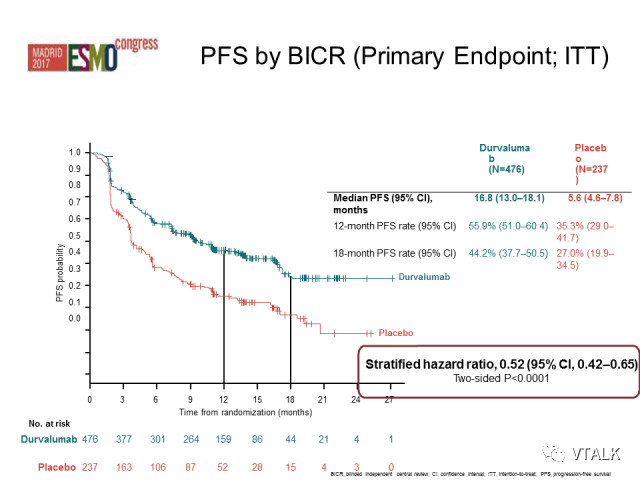
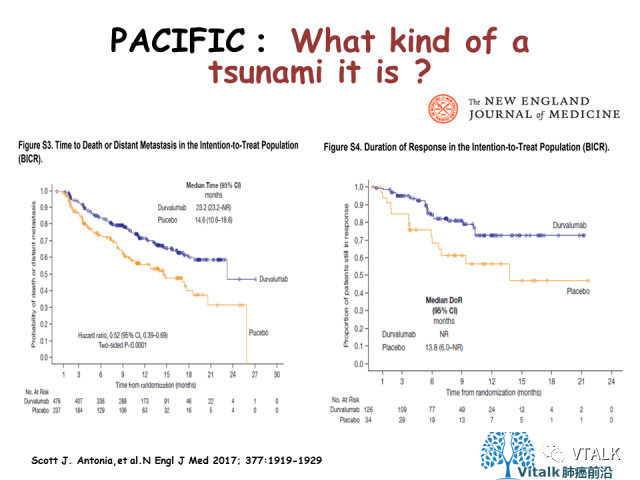
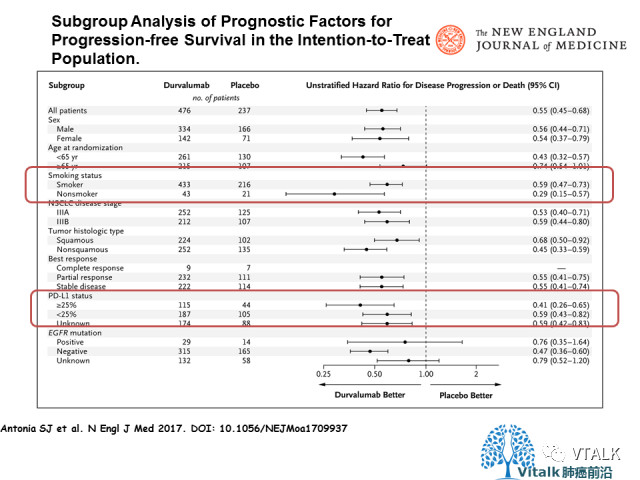
数据收集截至2018 年3 月,中位随访25.2 个月。结果显示,Durvalumab 总生存有显著改善和临床获益,24 个月时试验组OS 率为66.3%,对照组为55.6%(P=0.005);两组的中位OS 分别为未达到和28.7个月(HR=0.68,P=0.0025); 中位PFS 分别为17.2 个月和5.6 个月(HR=0.51,95%CI 0.41~0.63);中位死亡时间或远处转移时间分别为28.3 个月和16.2 个月(HR=0.53,95%CI 0.41~0.68); 新发脑转移发生率分别为6.3% 和11.8%; 中断研究治疗后,试验组和对照组分别有41.0% 和54.0% 的患者接受了额外的抗肿瘤治疗;研究者评估的死亡或再次进展的中位时间分别为28.3 个月和17.1 个月(HR=0.58,95%CI0.46~0.73)。试验组的生存获益在各亚组均可体现。
使用Durvalumab的患者与服用安慰剂的患者相比,发生肿瘤转移的风险更低。Durvalumab组对比安慰剂组,显著提高ORR,两组分别为28.4% vs. 16.0% (RR=1.78; 95%CI:1.27-2.51)。中位疗效持续时间分别为未达到vs. 13.8个月(HR=0.43;95%CI:0.22-0.84)。
在总人群和亚组人群分析中,与安慰剂组相比,Durvalumab组的至死亡或至远处转移时间、客观缓解率等次要研究终点也有显著改善。
安全性分析:Durvalumab组的不良事件发生率为68%,而安慰剂组为53%。两组免疫相关的不良反应发生率分别为24%和8%。两组严重肺炎(3~4级)发生率分别为3.4%和2.6%。Durvalumab组中有6.3%的患者因肺炎中断治疗,而安慰剂组为4.3%。 因此,PD-L1抑制剂Durvalumab是一种合理的、且耐受性良好的治疗方法,安全性可管理,可以改善PFS长达11个月。对局部晚期不可切除的III期肺癌患者而言,放化疗后接受PD-L1抗体免疫治疗是一种新的选择。
接受Durvalumab治疗的患者与使用安慰剂的患者相比,最常见的治疗相关不良事件 (AE) 是咳嗽(35.4% vs. 25.2%)、肺炎/放射性肺炎(33.9% vs. 24.8%)、疲劳(23.8% vs.20.5%)、呼吸困难(22.3% vs. 23.9%)以及腹泻(18.3% vs.18.8%)。
[以前的报道:试验组和对照组3~4 级不良事件发生率分别为30.5% 和26.1%;不良事件导致治疗中止率分别为15.4% 和9.8%,其中最常见的原因均为肺炎(4.8% vs. 2.6%)。另外,两组特别受重视的不良事件发生率分别为66.7% 和49.1%(1~2 级事件:56.8% vs.43.6%),严重不良事件发生率分别为29.1% 和23.1%,其中不良事件致死率为4.4% 和6.4%。在同步放化疗的基础上进行PD-L1抗体的巩固治疗,PFS达到16.8个月。]
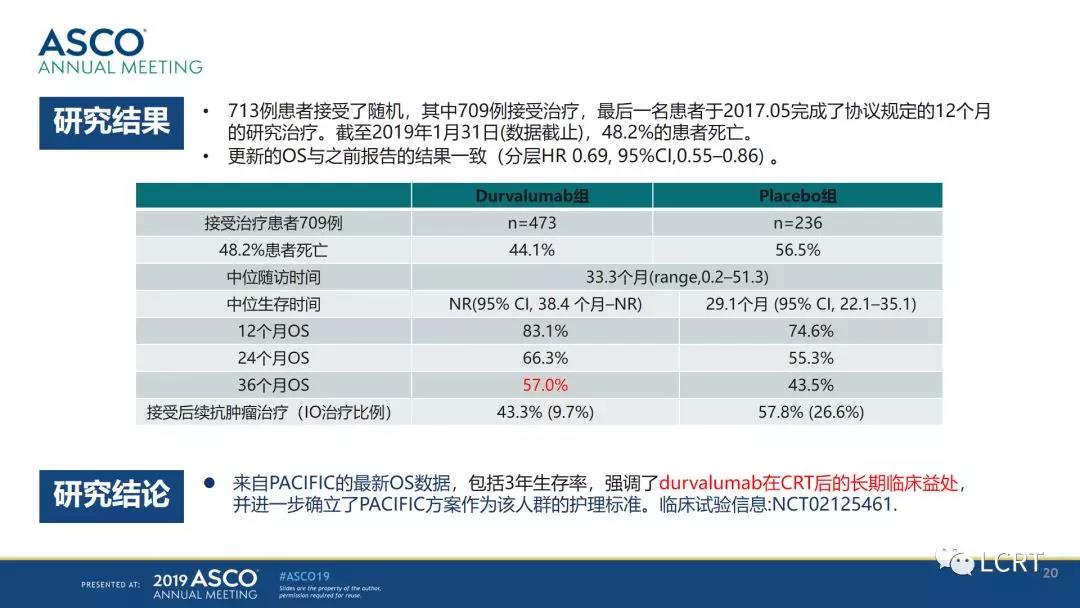
注意:化放疗组的中位生存时间达到29.1个月。这也是比较长的。
【结论】
Durvalumab可改善局部晚期不可切除的III期NSCLC患者的PFS。
【评论】
Durvalumab是第一个在III期NSCLC患者带来PFS显著获益的免疫检查点抑制剂。
历史数据显示III期不可切除的NSCLC患者经过同步放化疗后PFS为8~10个月,为何在PACIFIC研究中对照组PFS仅为5.6个月?PACIFIC研究的分组是在同步放化疗后6周开始的,如果加上临床试验研究中的随机化时间6周,因而PACIFIC研究中对照组PFS的时间与历史数据相当。
PACIFIC研究中免疫巩固治疗的ORR为28.4%,对照组为16%,为何ORR的提高不是很显著? PACIFIC研究中的免疫巩固治疗入组的人群是在同步放化疗达到SD以上疗效的患者。近年来的研究已证明,免疫效应是放疗控制肿瘤的机制之一。从这一“放射--免疫”机制的角度来分析,免疫巩固治疗与同步放化疗受益人群方面具有交叉,因而更重要的是体现在延长患者的免疫反应时间,即PFS。
PACIFIC研究中OS是否会有差别? 目前III期不可切除的NSCLC经过同步放化疗后的中位OS为20个月,我们可以推测PACIFIC研究的OS应该会是阳性结果,原因有以下几点:
(1)免疫巩固治疗组显示PFS大幅度提升,以往不管在一线、二线治疗人群,众多临床试验都支持免疫治疗PFS可转化为OS的延长;
(2)START研究中,不可手术的III期NSCLC同步放化疗后达到SD的患者采用MUC-1多肽免疫治疗作为巩固治疗可明显延长患者OS(30.8个月比20.6个月);
(3)已有回顾性临床研究显示,前期接受过放疗的患者使用Pembrolizumab治疗晚期NSCLC的平均OS达到11.6月,显著高于前期未接受过放疗的患者(5.3个月);
(4)已有回顾性研究显示,免疫治疗可改善肿瘤微环境,因而免疫治疗后出现耐药的患者可能具有更好的化疗反应性。
免疫表型具有可塑性。放疗不仅可以通过杀伤肿瘤细胞暴露肿瘤抗原,还可增强抗原递呈的活化和成熟,进而激发T细胞免疫效应。因而PACIFC研究中的同步放化疗方案可将部分“免疫荒漠型”患者转化为“免疫炎症型”,从而提高免疫治疗反应人群。
临床实践规范在免疫治疗时代的挑战。在肿瘤临床治疗实践中,患者在经过标准治疗后通常会选择观察和等待,待出现进展后再接受其它治疗。这是目前的临床实践规范。事实上,经过放疗或化疗后取得治疗效果的患者由于在治疗过程中出现了肿瘤细胞杀伤导致的抗原暴露、免疫抑制细胞的清除,更适合免疫治疗的效应发挥。未来,是否可考虑将免疫治疗应用在维持治疗阶段,值得进一步探讨。
针对中国人群的类似研究设计需要改变。在PACIFIC研究中,纳入的患者均是高加索人群。PACIFIC研究试验组和安慰剂组EGFR突变人群只有29例和14例,绝大部分纳入的患者是EGFR野生型。众所周知,高加索非鳞NSCLC人群和中国人群在驱动基因方面是有差异。如果将大量EGFR突变的人群也进行同步放化疗+巩固免疫治疗,结果会是一样吗? 所以,我们不可照搬PACIFIC研究的数据用于国人的治疗。
【相似研究】
【存在的问题】
如何在PACIFIC研究的基础上更进一步?目前,在一些动物模型的研究中显示,免疫检查点抑制剂联合放疗,有协同效应,优于单纯放疗,且在放疗开始后尽早使用免疫检查点抑制剂效果更好。目前正在进行这方面的临床研究探索(ETOP 6-14 NICOLAS研究)。
要解决的问题:
1、如何进一步细分III期患者从而制定相应治疗策略
2、探索不同临床亚型的最佳综合治疗策略:最优的化疗方案?最优的放疗计划?可切除患者的外科治疗策略?
3、免疫治疗的加入出现曙光,仍需解决的问题:最佳生物标记物?最合理的联合治疗模式?最佳的治疗时间?靶向药物治疗的地位?
4、这不是一个精准医学研究。需要有生物标记物。
5、疗效的评估?
6、失败的模式是什么?需要精细分析。
【更新】
2019-05-26
【参考文献】
1、Antonia SJ., et al. Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med. 2017; 377(20):1919-1929.
2、N Engl J Med. 2018 年9 月25 日在线版 doi: 10.1056/NEJMoa1809697
【作者】
杨学宁 广东省肺癌研究所
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)