
2019-04-19
“无论PD-L1表达水平是否为阳性(≥1%为cutoff),试验组患者的客观缓解率、无进展生存期和总生存期都显著提高。” KEYNOTE-189的这一结果随着K+化疗联用疗法的上市成为了热议话题,而这也正是O药早在美国上市非小细胞肺癌适应症时一直强调的“All-comer”概念(即不用考虑PD-L1的表达水平即可用药,无需做PD-L1伴随诊断)。
时间回到2015年,PD-1研发浪潮尚处在早期,K药和O药同时在二线非小细胞肺癌治疗上竞争。K药采用保守策略,二线非小细胞肺癌治疗只针对PD-L1表达水平≥50%的患者;而O药则更为大胆,这个PD-1领域第一个吃螃蟹的人在一开始就将二线治疗的患者范围扩大到了“无论PD-L1表达是否阳性”,也正是二线非小细胞肺癌的All-comer(无需检测PD-L1表达水平)策略使得O药在当时占据了一定市场优势。
在那之后,双方再度进入一线非小细胞肺癌领域的争霸,O药保持一贯的进取策略尝试一线All-comer(后来调整为覆盖所有PD-L1阳性患者,也就是著名的临床试验CheckMate-026,最终未能到达主要研究终点)。
在看到O药的CheckMate-026失利后,K药结合自身的KEYNOTE-001中PD-L1低表达和阴性情况下客观缓解率远低于高表达患者的已知情况(PD-L1<1%组10.7%;1-49%组16.5%,≥50%组45.3%),迅速将针对入组试验患者的PD-L1表达条件改为≥50%(KEYNOTE-024),力求稳妥。
事实证明K药此举是谓明智,一线单药使用时PD-L1<50%的患者并未达到统计学意义上显著提升患者的无进展生存期和总生存期,最终以治疗PD-L1水平≥50%的限制条件下在FDA获批一线(患者必须接受获得FDA批准的PD-L1检测手段检测,并且PD-L1水平必须达到50%,才能一线用药)。
当然,K药在求稳的同时,也并未停止前行的步伐,随后便启动了试水PD-L1≥1%的人群的临床试验KEYNOTE-042。2018年ASCO上报告KEYNOTE-042达到总体生存期(OS)主要终点并获得FDA优先审查。而就在上周,基于该研究结果,K药获FDA批准扩展其单药一线治疗肺癌适应症范围,将患者PD-L1表达标准降低到TPS≥1%。
但值得关注的是,该项研究里PD-L1≥50%人群接近一半(46.9%),同时 1-49%的人群OS获益并不显著,不具备统计学意义(K药组为13.4个月,对照化疗组为12.1个月,HR=0.92;0.77~1.11),因此压倒性意见认为整组OS优势来自PD-L1≥50%人群占比过高,进而拉高了整组OS水平。
而1-49%的人群OS获益并不显著或将成为专业人士对于K药单药尝试覆盖一线疗法PD-L1低表达或不表达患者最大的顾虑。因此,只有寻求与一线化疗药物联用才是最快速有效的路径,而本次在国内获批的K药与双化疗药联用正是出于这个逻辑。
事实证明,K药与双化疗药联用确实展现出良好的疗效,其总缓解率(肿瘤显著缩小比例)是单用化疗的两倍以上,48%对19%。
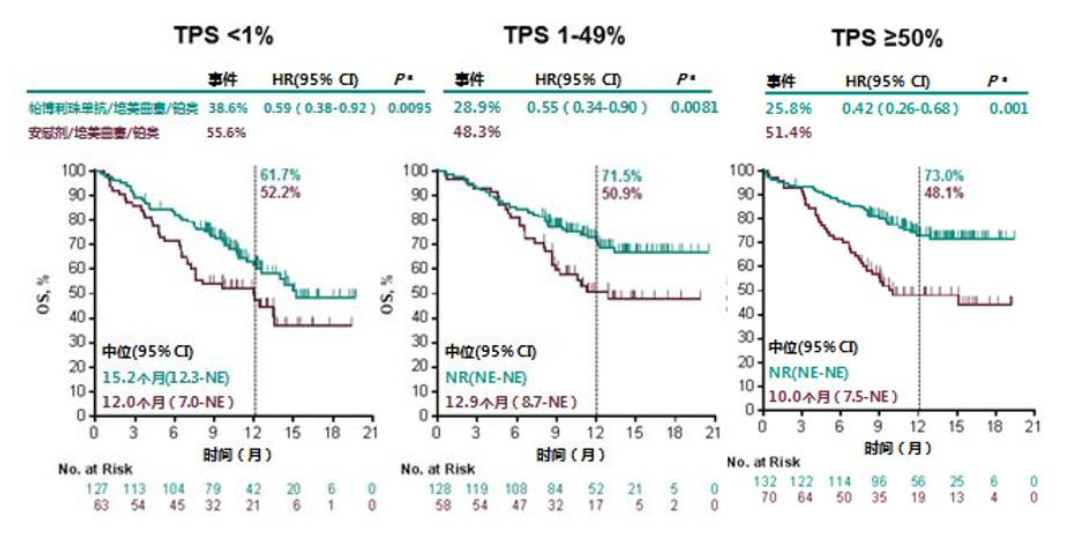
▲KEYNOTE-189研究OS结果
但对比传统化疗疗效增加的同时,K+化疗联合用药的不良反应也迅速增加。我们只看需要临床干预处理的3级以上不良反应(AE)发生率,K+化疗明显更高于传统化疗,最高居然达到了73.2%之高,同时不良反应导致的死亡率是6.7%。因此,目前多数医生对免疫联合化疗的态度较为保守,“需要挑患者,体质是个硬条件”。
回到O药,在不同的PD-L1表达水平分层时表现如何?
无论是CheckMate-057、-017、-003还是-063,抑或是针对中国人群的-078,都表明了无论PD-L1表达水平,患者都能从O药中获益。
同时患者的生存时间与PD-L1表达水平呈正相关,CA209-003更是发现如果患者的PD-L1表达水平超过50%,5年生存率可高达43%。
对于PD-L1<1%的患者,5年生存率竟然也有20%,未检测PD-L1水平的患者,也有10%的生存时间超过5年。
研究者还发现PD-L1<1%的患者一旦获益,他们的总生存期(OS)一点都不比PD-L1≥50%的患者差。那些经过O药治疗后得到缓解的PD-L1<1%患者,不仅总生存期长,而且持续缓解时间(DOR)也能与PD-L1≥50%的患者比肩。
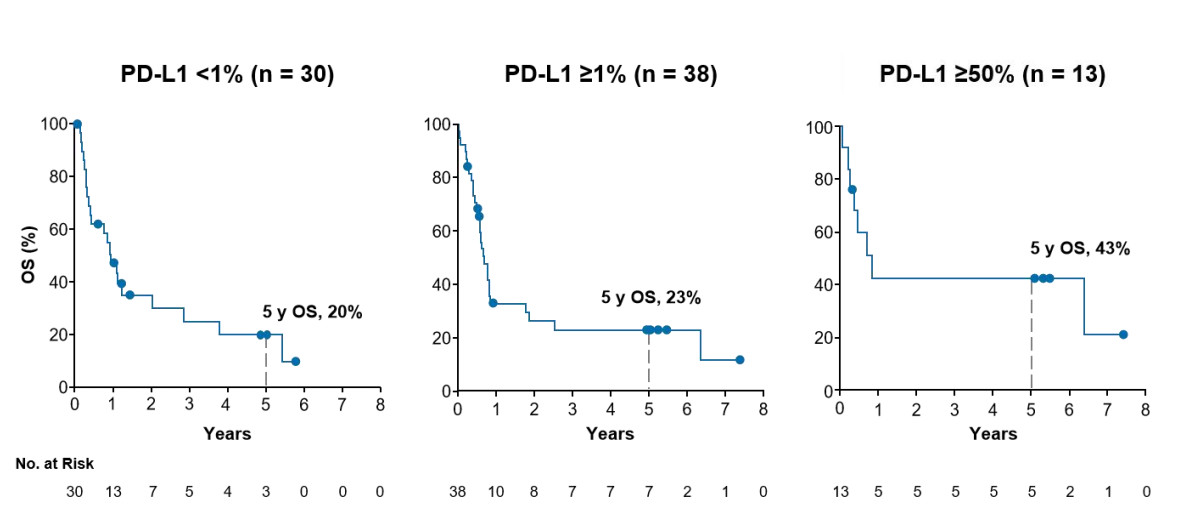
▲Opdivo CA209-003临床数据
所以FDA和NMPA在批准O药用于非小细胞肺癌的二线治疗时,并不要求检测PD-L1的表达水平。无论患者的PD-L1表达水平如何,都可以直接在二线接受O药治疗。前文提到的BMS最新发布的四项临床研究长期生存汇总——分析结果显示PD-L1≥1%与<1%的患者群体四年总生存(OS)率分别为19%与11%——则再次验证了O药是目前真正意义上的All-comer。
最终,All-comer只是一个概念,唯有患者生存数据才能赋予它真正的意义。无论是PD-L1表达还是其他更多元的肿瘤标志物的研究,其最终目的都是希望在不久的将来,非小细胞肺癌患者中将不再有“孤儿”,真正实现个体化免疫治疗。
作者:shy
【文献参考】
1、N Engl J Med. 2018 年4 月16 在线版 doi: 10.1056/NEJMoa1801005; 2018年AACR 大会. 摘要号CT075
2019年AACR 大会
2、Tony S KMok, Yi-Long Wu, Iveta Kudaba, et al. Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic Non-small-cell lung cancer (KEYNOTE-042): a randomized, open-label, controlled, phase 3 trial. The Lancet. Published Online April 4, 2019.4.
3、Borghaei H, Paz-Ares L, Hoen L, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015 Sep 27.
4、Study of BMS-936558 (Nivolumab) Compared to Docetaxel in Previously Treated Advanced or Metastatic Squamous Cell Non-small Cell Lung Cancer (NSCLC) (CheckMate 017)
5、 Rizvi NA,Mazieres J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1immune checkpoint inhibitor, for patients with advanced, refractory squamousnon-small-cell lung cancer (CheckMate 063): A phase 2, single-arm trial[J].Lancet Oncol, 2015, 16(3): 257-265.
6、Wu Y-L, Lu S, Cheng Y, et al. NivolumabVersus Docetaxel in a Predominantly Chinese Patient Population With PreviouslyTreated Advanced Non-Small Cell Lung Cancer: CheckMate 078 Randomized Phase IIIClinical Trial, Journal of Thoracic Oncology (2019),
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)