
2018-08-22
1. 常规放疗
最早期的放疗方法。医生通过模拟定位机透视,确定肿瘤大体范围,然后用在病人皮肤上标记治疗范围。由于机器条件有限,只能做正方形、长方形等简单规则照射野。使得肿瘤照射区域累及周边很多正常组织。目前,这种方法在国内的肿瘤医院放疗科已经很少应用。
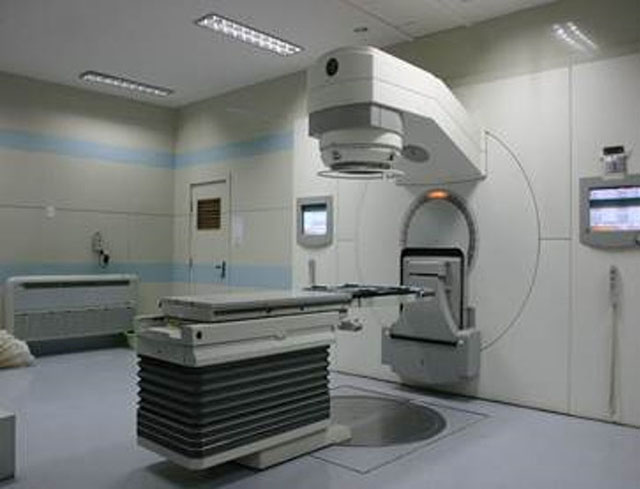
2. 三维适形放疗(3DCRT)
适形放疗的出现是为了克服普通放疗过多照射正常组织的问题,它从多个角度照射肿瘤,而且每个入射角度的射线投影都和那个角度所看到的肿瘤形状相一致。在三维方向上的入射射线都与病变一致,使最终的高剂量区适合肿瘤的形状了,即“适形”放疗。利用体位固定热塑体膜、体架、真空垫等固定装置把患者固定在定位床上,利用CT模拟机进行定位,在CT图像重建出的人体模型上勾画靶区,这样肿瘤靶区更精准、周围的正常组织位置也更清晰。利用三维计划系统按照CT重建出来的人体模型模拟照射,制定合理的治疗计划,适形放疗使肿瘤靶区更精确,正常组织的损伤更小。
适应症与不足:适形放疗可以满足多数肿瘤的基本治疗要求,适应症广泛。
而在与周围正常组织关系紧密的肿瘤放疗中,仅仅照射野的形状适形还是不够的;还需要做到照射野内部剂量强度的调节以做到。
3. 调强放疗(IMRT)
调强放疗根据肿瘤的三维形状和危及器官具体解剖关系,通过各种照射实施方式对束流强度进行调节,使照射野内剂量分布更佳合理和均匀。临床研究证明调强放疗比三维适形放疗疗效更好,造成的正常组织损伤更小。但是调强放疗对患者治疗体位固定要求更精确,因为微小的体位移动都可能会把肿瘤的遗漏或者重要器官受到不必要的照射。
适应症与不足: 调强放疗适用于肿瘤周边有很多正常组织的放疗,以及需要在治疗区域内的高危区域每次治疗时特别再加量的情况。调强放疗对患者的摆位精度、医生靶区勾画能力、物理师的计算水平都是考验。调强放疗需要有经验的放疗团队。否则,精确地打击就可能会变成精确地遗漏。
4,立体定向治疗(SRT)
立体定向是利用影像技术,借助固定装置和计算机的运算得到病变在体内的精确空间位置的一种技术。SRT就是利用立体定向技术进行病变定位 ,用小野集束单次大剂量照射靶区 ,使之产生局灶性坏死,从而达到类似手术的效果。以其精确的立体定位和靶结构与周围组织之间受照射剂量陡峭的梯度变化,在几乎不损伤周围组织的情况下摧毁靶组织。主要运用于脑部肿瘤。
SRT的设备和放射源: 包括γ刀和X刀。两者均为放疗的一种特殊技术,而不是真的开刀手术!由钴-60作为放射源的立体定向放疗称为γ刀,由加速器作为放射源的立体定向放疗称为X刀。两种“刀”都是放射线通过多个不同的方向聚焦到肿瘤灶,在破坏肿瘤的同时能较好地保护周围正常组织如同手术刀一样杀灭肿瘤,所以形象地比喻“刀”。
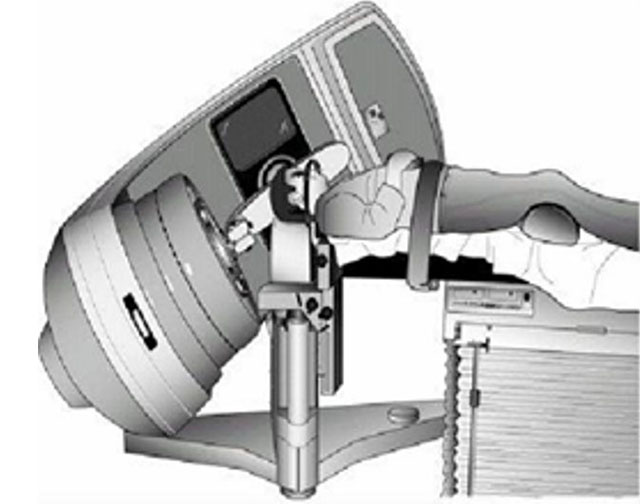
适应症与不足: 病变位于颅脑的重要功能区不宜手术或难以手术者;颅内肿瘤手术后残留或复发者;单发或多发的脑转移瘤;作为全脑照射的补充治疗。适合直径小于5cm的病变。不足:主要治疗比较小的病变。同样需要高水平的团队来完成。
两种“刀”的比较:
γ刀:造价昂贵,更加精准,有创固定,一般只作一次,适合颅内30mm以下的病变
X刀:造价低,易于改装,不如γ刀精确,无创固定,可分次照射,适于对较大病灶不规则病灶
5. 大剂量立体消融放疗(SABR)
大剂量立体消融放疗是立体定向放疗的延伸。最早SRT从头部延伸到体部被叫做立体定向体部放疗(stereotactic body radiation therapy,SBRT)。美国MD安德森癌症中心的张玉蛟教授等人采用的大剂量SBRT技术在早期肺癌中取得了良好的局部控制率,达到和手术相媲美的临床结果,被专门定义为立体定向消融放疗(SABR)。
适应症和不足: 不能耐受手术的老年患者,SABR单次剂量特别高,所以每次治疗都需要进行图像引导。因此治疗耗时较长(大约30-45分钟),但是整体治疗周期短,只需要一周左右。近年来带有图像引导的γ刀开始应用于临床,SABR的未来值得期待。
射波刀(赛博刀) 是一种加载在360°旋转机械臂上的6MV微型直线加速器。加速器的等中心可以随靶区的变化而同步变化,在图像引导和呼吸门控帮助下,实现了对单个或多个病灶同时治疗,精准度非常高,误差不到1mm。其精确度使得医生可以安全地使用大剂量照射,周边健康组织受到的损伤更小,患者一般只需要1到5次即可完成治疗。
适应症和不足: 射波刀在肿瘤类型、肿瘤大小上有很多限制,一般对于4cm 以下的肿瘤,高度规则的,容积较小的肿瘤治疗效果比较好。但是人体是活动的,由于心脏及肺的运动,尤其心脏的跳动使得这些“刀”的定位很难达到既能完全覆盖又不损伤心脏肺的目的。不能照射大病灶。对于存在多发转移情况的患者,如果采用射波刀治疗,一次只能治疗一个病灶部位,次数多,时间长,费用高。
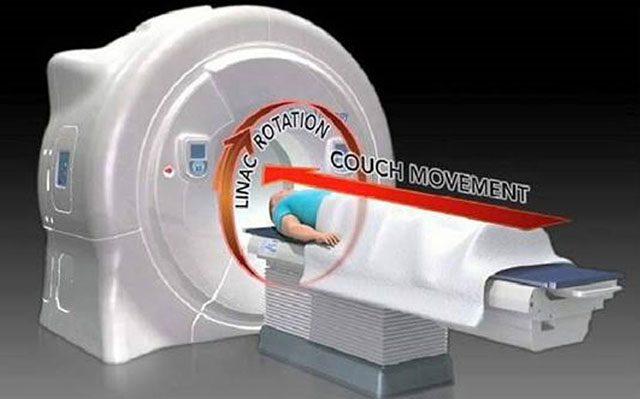
6. TOMO放疗
即螺旋断层放射治疗系统,集调强适形放疗IMRT、影像引导调强适形放疗IGRT、剂量引导调强适形放疗DGRT为一体,在CT校准和引导下,进行360°聚焦断层照射肿瘤,TOMO实现了肿瘤的自适应放疗,对恶性肿瘤进行高效精确的治疗。在每次治疗前都会和历史影像进行对比,根据患者肿瘤部位每日的变化动态实时地调整照射范围和角度、剂量。
适应症和不足: Tomo可以应用于全身各种肿瘤。尤其适合全脑全脊髓照射,可以从头到脚无接缝地照射。在超长、超大照射野的治疗上Tomo放疗有明显的优势。例如骨髓移植前对病人行全身或全骨髓照射,或儿童脑瘤中的神经管胚细胞瘤,需要做中枢系统全脑全脊髓的照射。对于存在多发转移情况的患者,如果通过Tomo放射治疗,可以对所有发现的病灶部位同时进行放射治疗,而且能保证不同的部位给予不同的放射剂量,治疗效果更好,时间更短。但是,由于全身断层扫描,Tomo全身受到低剂量照射的范围增加;并且Tomo放疗设备也非常昂贵,患者治疗花费高。
7. 重离子治疗
包括质子,中子,负π介子和碳,氧等重粒子。粒子束穿过组织时逐渐释放其能量,但当达到某一深度时,能量释放明显增加,这个深度范围称为该粒子束的“Bragg峰”。“Bragg峰”的宽度和深度以及粒子束的形状可通过限束、滤过装置调节,使其更符合病灶的形状。这些特点使之很适合作为立体定向放疗的放射源,在治疗时使粒子束的“Bragg峰”与病灶重叠,经过4个方向照射即可达到理想的剂量分布,病灶周围组织几乎不受到损害。重离子放疗设备主要分布在北美和欧洲。尽管这一技术早在20世纪50年代就用于临床,但由于加速器笨重,造价昂贵,治疗费时,临床运用并非十分成熟,正在积累临床应用数据、经验,目前仅有少数机构使用。
8. 术中放疗
术中放疗(IORT)简而言之就是在手术中切除恶性肿瘤组织后,对于可根除性肿瘤,可疑非根除性肿瘤或手术不能切除的肿瘤,术中给予一次性大剂量照射治疗。一方面:IORT技术是将传统上手术治疗与近几十年发展起来的放射治疗技术进行有效地结合,配合其他手段可以达到任何单一技术有时无法实现的疗效。另一方面:不同于外照射放疗(由于受到周围正常组织耐受量的限制,为得到均匀足够的照射量,须选择不同能量的射线采用多野照射技术),IORT直接作用于治疗部位,单次大剂量相当于分次外照射剂量生物效应的2.5倍。
术中放疗的优势在于:
1)适用范围广:可进行预防性术中照射,又可进行治疗性术中照射;可进行根治性照射,也可进行姑息性照射;可进行深部照射,且可实施体外浅表部位的照射。
2)适应症相对明确。
3)既能通过给予一次性较大治疗剂量,改善局部控制,提高治疗比,又能保护正常组织
【作者】 陈志勇 广东省肺癌研究所
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)