
2017-10-05
● 癌基因
● 抑癌基因
● DNA错配修复基因
一、癌基因(Oncogene)
1. 癌基因:病毒或细胞中存在的、能诱导细胞转化,并使其获得更多新生物学特性的基因
分类:
(1)病毒癌基因:存在于病毒中的癌基因;分为RNA病毒癌基因和DNA病毒癌基因
(2)细胞癌基因:存在于细胞中的癌基因
(3)原癌基因:即细胞癌基因,正常情况下是以非激活状态存在于细胞中,具有调节细胞生长、增殖、发育和分化的作用。而癌基因系原癌基因的活化形式,具有恶性转化能力
2. 癌基因致癌机制: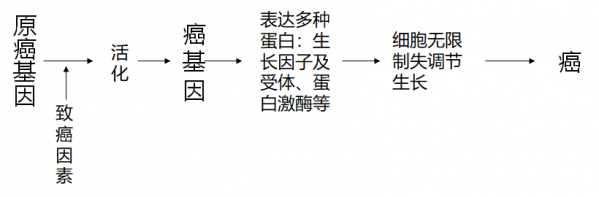
3. 与肿瘤有关的癌基因:abl(慢粒)、bcl-2(B细胞淋巴瘤)、lck(结肠癌)、ras、src、myc、Hist(胃癌)、ret(甲状腺癌)、sis
癌基因的异常表达
● 癌基因突变
● 癌基因低甲基化
● 癌基因扩增
● 染色体易位(基因重排,融合基因)
二、抑癌基因
1. 抑癌基因:存在于正常细胞内的抑制肿瘤发生的基因
(1)正常功能:保持染色体稳定、抑制细胞增殖、促进细胞分化
(2)抑癌机制:维持正常细胞膜表面、抑制细胞增殖相关基因的表达、调节细胞周期、促进细胞凋亡、调节细胞内信号传导等
(3)举例:P53、BRCA1、BRCA2、Rb、WT1、NF1、NF2、nm23
2. 抑癌基因只有其基因座上两个等位基因都发生缺失或失活才会导致肿瘤——“肿瘤的二次突变学说”
散发性肿瘤
3. 遗传性肿瘤
(1)抑癌基因的突变 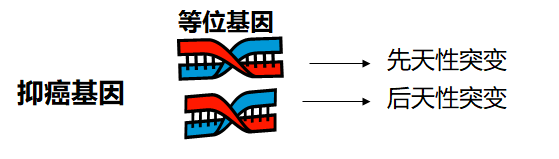
抑癌基因失活
● 抑癌基因缺失
● 抑癌基因高甲基化
三、错配修复基因
1. 错配修复基因:具有修复DNA复制过程中发生的错误功能的基因
2. 常见基因有:MSH2, MLH1, MSH3, MSH6等
3. 错配修复基因是看门基因,对于保护基因内部的稳定性和完整性具有重要意义
4. 相关肿瘤:家族性非息肉病性结直肠癌(HNPCC)
肿瘤与遗传的关系
肿瘤的发生与发展是一个漫长的多步骤过程,其中每一步都是由于遗传物质的改变而引起的。 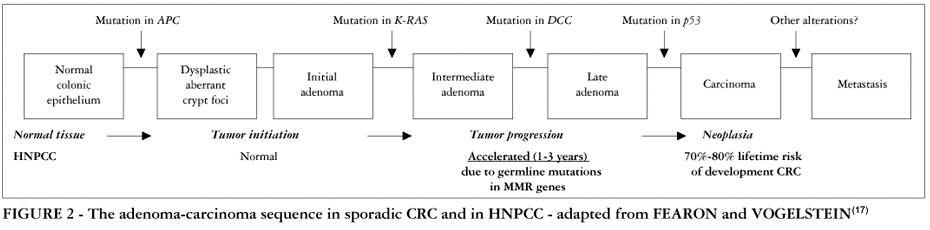
根据基因突变发生在不同的细胞,肿瘤可以分为散发性肿瘤和家族性肿瘤。如基因突变发生在体细胞,可导致相应部位的肿瘤,这些肿瘤都属于散发性肿瘤。如基因突变发生在生殖细胞,则可导致家族性肿瘤。
绝大多数的恶性肿瘤(>95%)是散发性肿瘤。目前所确定的家族性肿瘤包括家族性乳腺癌、鼻咽癌、前列腺癌及结直肠癌 。另外,食道癌和肝癌也有较强的遗传倾向。
遗传物质的改变
1. 癌基因的激活
癌基因的激活可以因基因拷贝扩增或基因调控的改变而引起。
2. 抑癌基因的失活
抑癌基因的失活可以因基因突变、基因拷贝缺失、启动子甲基化关闭基因表达及miRNA抑制基因表达等引起。
遗传性癌综合症
● 视网膜母细胞瘤(RB)
1971年,Knudson根据视网膜母细胞瘤的发生,提出了“两次击中理论”。1978年,Yunis 根据13q14区带在视网膜母细胞瘤中的缺失,将Rb基因定位于13q14 。1986年Friend等克隆了Rb基因。
● 家族性腺瘤性息肉病(FAP)
一般在20岁左右发病,表现为多发性大肠腺瘤,如不治疗,部分腺瘤会恶变。1987年,Bodmer等通过遗传连锁分析将FAP基因定位于5q。1991年APC基因被克隆。
● 遗传性乳腺癌(HBC)
HBC占全部乳腺癌的5%-10%。已被克隆的遗传性乳腺癌相关的基因有BRCA1和BRCA2。
肿瘤易感基因与肿瘤发生的关系
1. DNA修复缺陷与基因组不稳定性
2. G1/S checkpoint调控失调
3. 细胞凋亡机制缺陷
4. 启动子甲基化与基因关闭
如何区别散发性和家族性肿瘤
● 家族史
● 发病年龄明显提前
● 易感基因突变
校对:小全 2019年11月3日
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)