
2017-10-05
免疫监视学说认为:机体的免疫系统可以发挥监视作用,识别并消灭任何表达新抗原的“异己”成分或突变细胞,以保持机体内环境的稳定。当机体免疫功能低下时,无法有效清除异己成分和突变细胞时,就可能发生肿瘤。
支持证据:原发免疫缺损与恶性肿瘤高发生率;器官移植免疫抑制病人肿瘤发生率增高。艾滋病人易患Burkitt’s淋巴瘤。扁桃体切除后淋巴瘤发生机率升高。免疫疗法对某些肿瘤有效。
不支持的证据:监视学说是指所有肿瘤,而前者肿瘤均限于淋巴系统肿瘤,其他肿瘤类型很少发生。免疫治疗效果有限。
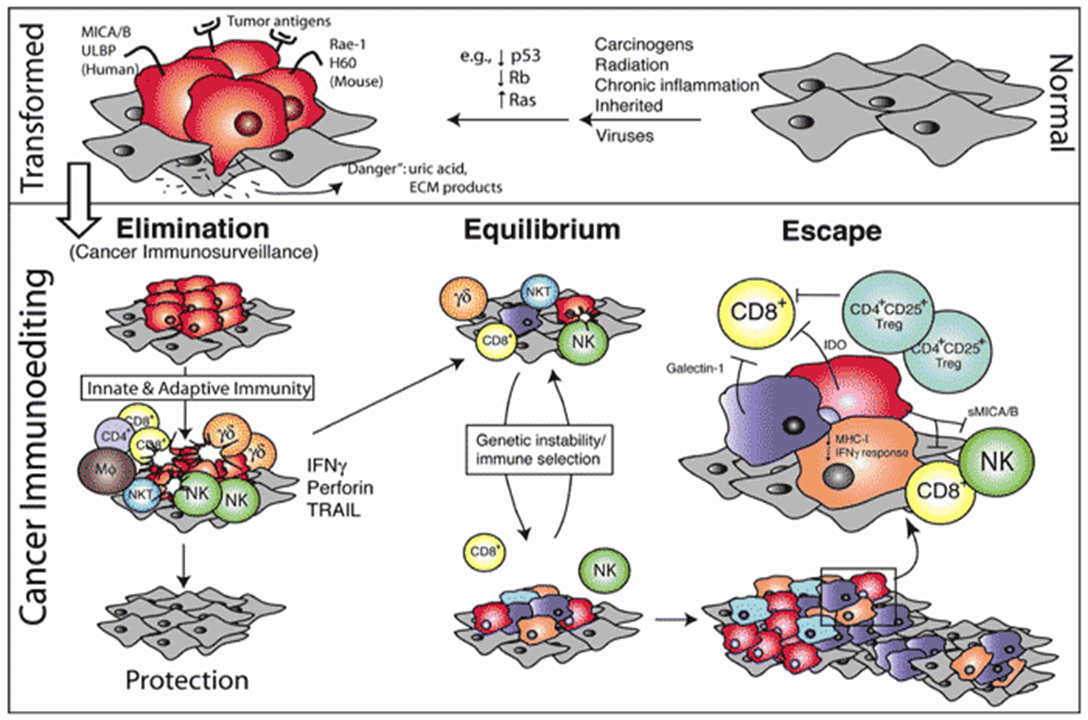
传统的肿瘤免疫监视学说已不能完全涵盖这一概念,因此Schreiber和Dunn等于2002年首次提出了肿瘤免疫编辑学说。
肿瘤免疫编辑包括免疫监视和肿瘤的免疫逃逸。
肿瘤免疫编辑分为三个过程:
1. 免疫清除过程:机体免疫系统识别肿瘤并通过多种途径杀伤肿瘤细胞。如果成功,肿瘤免疫编辑就此结束。
2. 免疫对抗过程:这是一个长期的进程,在这个过程中,肿瘤细胞在免疫系统的监视下,虽有少量残存,但不致为害,不影响机体的正常生活。在人类可达10—20年。
3. 免疫逃逸过程:免疫系统杀伤肿瘤的作用逐渐减弱—不能清除肿瘤细胞。肿瘤细胞对抗免疫细胞的能力逐渐增强,有时肿瘤细胞还有杀伤免疫细胞的现象。
肿瘤是如何逃逸免疫系统攻击的?
肿瘤细胞通过改变膜分子、抗原调变及分泌免疫抑制分子
肿瘤营造免疫抑制微环境,对免疫细胞“再教育”
免疫逃逸的方式
1. Fas/FasL介导的免疫逃逸
2. 肿瘤抗原的免疫原性降低及抗原调变
3. 肿瘤细胞表面 MHC 分子表达缺陷或表达量降低
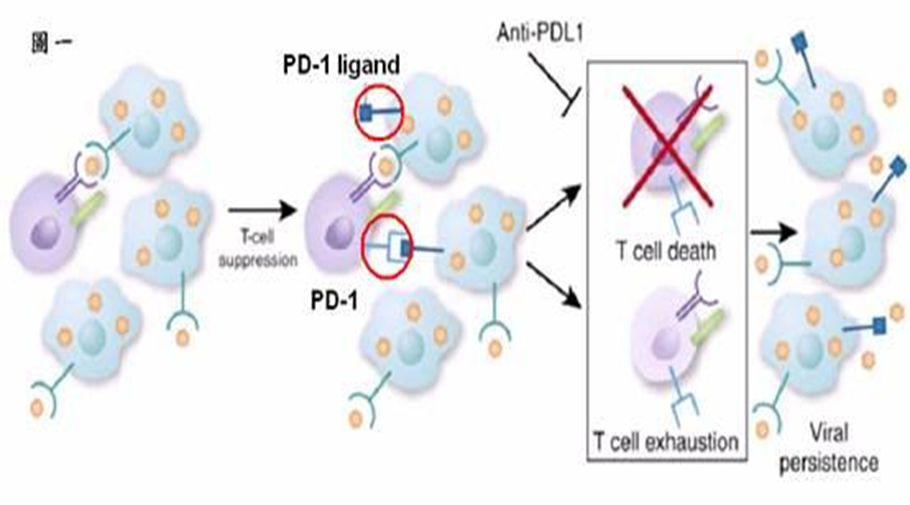
4. 肿瘤细胞表达PD-L1及CTLA-4等免疫抑制分子使T细胞失能
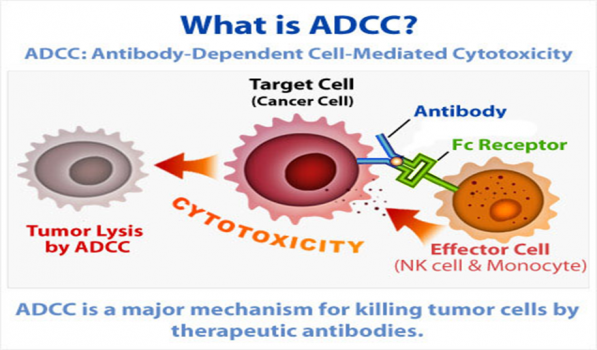
5. 肿瘤细胞释放出肿瘤抗原分子,与抗体结合成复合物,通过抗体的FC段与NK细胞、巨噬细胞的FC受体结合,从而封闭ADCC效应.
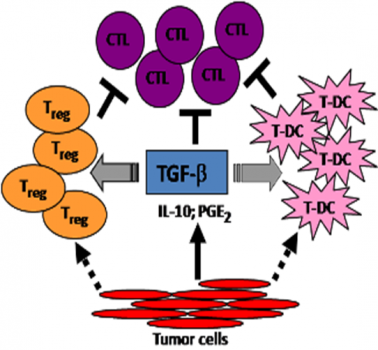
6. 肿瘤细胞可自分泌或旁分泌一些免疫抑制性细胞因子,如 IL-10,TGF-β等 .
肿瘤细胞表达PD-L1及CTLA-4等免疫抑制分子使T细胞失能
肿瘤细胞释放出肿瘤抗原分子,与抗体结合成复合物,通过抗体的FC段与NK细胞、巨噬细胞的FC受体结合,从而封闭ADCC效应
肿瘤细胞可自分泌或旁分泌一些免疫抑制性细胞因子
肿瘤局部微环境内存在多种抑制性细胞亚群
1. 调节性T细胞(regulatory T cells, Treg)
2. 髓系来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)
3. 肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)
4. 调节性树突状细胞( regulatory DC)
髓系来源的抑制性细胞(myeloid-derived suppressor cells, MDSCs)
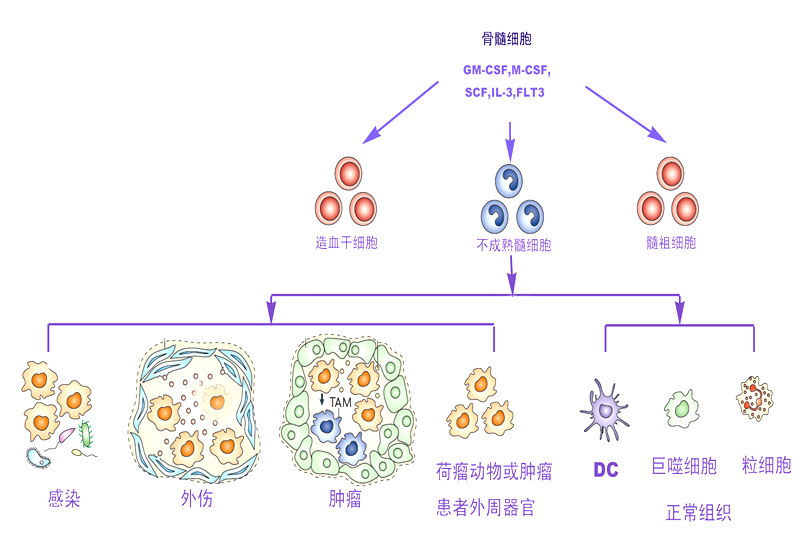
抑制T细胞的杀伤能力
抑制DC的抗原递呈能力
抑制NK细胞表达细胞毒性标志NKG2D以及IFN-γ
肿瘤相关巨噬细胞(tumor-associated macrophages, TAM)
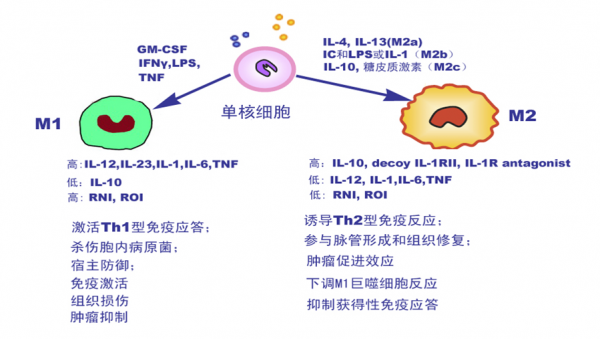
肿瘤局部微环境内的细胞因子种类
● IL-10、IL-6、IL-4、IL-13、IL-1β、TGF-β、GM-CSF、VEGF、SCF、M-CSF
● 趋化因子如CCL2、CCL5、CCL12、CCL19、CCL20、CCL21等
● PGE2、 iNOS、IDO及精氨酸酶
● CTLA-4
影响肿瘤免疫机制
理论上讲,单个突变的细胞无限制地生长就可以形成肿瘤。人体每天约有1014以上的细胞分裂复制,细胞突变率为10-7~10-5,这样人体每天有107~109个细胞发生突变。然而,事实上只有极少数的细胞在少有的情况下能够继续分裂生长,并且逃脱免疫系统的监视而形成肿瘤。这些肿瘤逃脱免疫系统监视的原因可能与下面机制有关:
1. 肿瘤细胞的弱免疫原性:
免疫原是指能诱导机体产生免疫应答的物质,通常免疫原的来源与应答者之间在进化过程中相距越远,免疫原性就越强,如细菌、病毒等对于人体来讲就具有强的免疫原性。但肿瘤来源于机体自身突变的细胞,大部分的成分与机体正常细胞的成分相同,只有极少数异常表达的蛋白质和畸形多糖 (如:糖链的异位合成、隐蔽糖链的暴露、糖链合成不全) 具有免疫原性。对动物肿瘤而言,致瘤病毒诱发的肿瘤免疫原性最强,化学致癌物诱导的肿瘤免疫原性次之,自发性肿瘤的免疫原性最弱。同一类型的肿瘤在不同的个体中,肿瘤的抗原性可以不同,即使同一个体内不同部位、甚至同一部位不同结节肿瘤的免疫原性也可不同。
人类肿瘤是自发的,因而肿瘤的免疫原性大多很弱。由于肿瘤细胞之间也存在免疫原性不同的差异,那些免疫原性较强的肿瘤细胞可以诱导有效的抗肿瘤免疫反应,易被机体消灭,而那些免疫原性相对较弱的肿瘤细胞则能逃脱免疫系统的监视而选择性地增殖,这一过程称为免疫选择;经过不断的选择,肿瘤的免疫原性越来越弱。所幸的是,人们已经发现了人类肿瘤特异性的抗原基因,并应用基因导入、细胞因子处理等多种方式以提高肿瘤细胞的免疫原性,增强机体的抗肿瘤免疫反应。
抗原调变(antigenic modulation):抗体与肿瘤抗原结合的结果导致该抗原丢失。抗原调变是抗原抗体复合物的内化或脱落所致,它是被动免疫抗体治疗的一大障碍。肿瘤细胞表面抗原还可被某些分子所遮盖,如包括唾液酸在内的粘多糖,肿瘤细胞表面通常比正常细胞表面表达更多的糖脂和糖蛋白。
MHC分子具有抗原递呈功能。没有MHC-I类分子和II类分子的递呈,肿瘤抗原不可能激活T细胞。MHC-I类分子递呈功能的缺乏常常是导致肿瘤免疫逃逸的主要原因之一,可以由MHC-I类分子mRNA转录水平的降低,基因组的丢失,β2微球蛋白基因的突变等引起。IFN-γ处理的肿瘤细胞表面MHC-I类分子的表达可恢复正常。但有些肿瘤细胞表面的MHC-I类分子的水平并不降低,这可能与它们缺乏MHC-II类分子和B7分子有关。将MHC-I类分子和II类基因导入肿瘤细胞后可以使肿瘤的致瘤性下降并增加免疫原性。
2. T细胞耐受和T细胞缺陷:
T细胞激活时不仅需要肿瘤抗原和MHC分子,而且还需要协同刺激信号。如缺乏协同刺激信号将不能形成有效的免疫应答而产生免疫耐受。研究得较多的协同刺激信号分子B7,主要表达在激活的B细胞、树突状细胞、激活的巨噬细胞等,而在肿瘤细胞表面的表达通常缺如。有些肿瘤细胞可以通过其表面的MHC分子将肿瘤抗原直接递呈给T细胞,由于缺乏协同刺激信号,不能激活T细胞,相反却诱导产生了T细胞耐受。有些肿瘤抗原虽然能被巨噬细胞等吞噬处理,通过这些专职的抗原递呈细胞递呈,但由于缺乏能诱导B7分子表达的因子(如IFN-γ),抗原递呈细胞表面的B7分子没有被诱导表达,同样也会因缺乏协同刺激信号而导致免疫耐受。
肿瘤细胞还可能诱导T细胞克隆删除。Fas和FasL属于肿瘤坏死因子受体和肿瘤坏死因子蛋白超家族的成员,FasL或Fas抗体与细胞表面的Fas分子结合会诱导该细胞的凋亡。T细胞表面一般都表达Fas分子,有些肿瘤细胞会表达FasL。浸润到这些肿瘤周围的T细胞通过T细胞受体识别肿瘤抗原和MHC-I类分子的复合物,同时与肿瘤细胞上的FasL结合,导致这些T细胞的凋亡,造成T细胞克隆删除。因此,肿瘤组织可能形成免疫豁免区。
T细胞信号传导链表达低下或缺失而失去抗肿瘤作用:长期以来,研究人员还发现肿瘤个体的T细胞在体外对有丝分裂原的反应性降低,体内的迟发性超敏反应实验反应性也降低,后来发现这是由于肿瘤宿主的T细胞缺陷所致。MHC分子递呈的抗原肽与T细胞受体结合后需经TCR/CD3以及一系列信号传导系统,最后才能激活相关的基因而发挥生物学功能。CD3分子与T细胞受体共价连接,肿瘤患者T细胞CD3分子的链常常表达下降,且信号传导过程中涉及到的p56lck和p59fyn等分子的表达也会出现异常,这都会导致T细胞的活化障碍。体外用抗CD3和CD28分子的单克隆抗体以及 IL-2刺激可以使这种T细胞障碍得到部分恢复。
3. 抑制性T细胞(suppressor T cell, Ts):
以前认为抑制性T细胞属于CD8+T细胞,目前对抑制性T细胞有了进一步的认识。它既可来自CD8+T细胞也可来自CD4+T细胞。一些抑制性T细胞作用是抗原非特异性的,如CD4+Th1和CD4+Th2辅助性T细胞各自产生细胞因子非特异性地抑制对方。肿瘤宿主可增强这种非特异性免疫抑制。抑制性T细胞通过释放的可溶性T细胞受体,可溶性IL-2R,及免疫抑制因子(如TGF-β、IL-10等)抑制抗肿瘤免疫。抑制性T细胞也可以是高度抗原特异性的。一些研究表明:抗原特异性抑制是由CTL介导的,它们识别辅助性T细胞受体上的独特型决定族,并且破坏这些细胞。另一些研究证实:CD4+ Th1 CTL识别抗原递呈细胞上的抗原,并破坏抗原递呈细胞。还有研究证实:分离荷瘤宿主体内激活的γδT细胞,体外培养后产生CTL-抑制因子(CTL-IF)。
4. 抑制性巨噬细胞:
过渡活化的巨噬细胞可抑制淋巴细胞的增殖,抑制NK和CTL抗肿瘤活性。抑制性巨噬细胞是否为特异分化阶段的巨噬细胞,还是巨噬细胞某个亚群尚不清楚。现已发现肿瘤宿主中骨髓来源的粒细胞巨噬细胞的前体CD34+细胞具有天然的抑制活性,这种抑制活性可被维生素D3逆转。肿瘤产生的许多因子,如:IL-4、6、10、TGF-β、 PGE2 和GM-CSF能够逆转和抑制活化巨噬细胞的细胞毒活性,诱导巨噬细胞的抑制活性。
5. 抗原递呈功能障碍:
研究表明荷瘤宿主外周血获得的DC往往对抗原递呈有障碍。而取自荷瘤宿主骨髓细胞在体外与GM-CSF、IL-4、TNF-a共同培养扩增的DC抗原递呈功能良好,表明肿瘤宿主的DC可能从骨髓释放到体内的成熟过程中受到了荷瘤宿主体内某些因素的干扰而削弱了对抗原的呈递作用。
6. 免疫抑制因子:
带瘤动物和肿瘤患者的免疫抑制状态常可随肿瘤的切除而消失。经检测,多种动物和人类肿瘤的提取物、血清及建系的肿瘤细胞培养上清中存在免疫抑制因子,主要有TGF-β,IL-10和前列腺素E2等。
转化生长因子-β (transforming growth factor-β,TGF-β):是迄今发现的最强的肿瘤诱导产生的免疫抑制因子。多种肿瘤分泌TGF-β,在很多荷瘤宿主血浆中也发现有TGF-β。TGF-β在动物实验中能促进肿瘤的侵袭和转移。它能对抗 IL-2引起的免疫刺激作用,抑制NK和LAK细胞的活性,抑制 IL-2R的表达,抑制抗原特异CTL的诱导产生,以及T、B细胞的增殖反应。有些肿瘤分泌TGF-β的量还与它们的进展和预后有关,具有较高水平TGF-β 的肿瘤患者预后较差。用TGF-β的抗体或TGF-β反义核酸处理能中和TGF-β的抑制作用,在动物实验中能降低肿瘤的转移能力。
白细胞介素10:机体的免疫功能通过正向和负向调节两方面彼此协调,相互制约而取得自稳。IL-10是一种重要的负向调节因子,在很多人类肿瘤中都有表达,如肾癌、结肠癌、乳腺癌、胰腺癌、黑色素瘤及神经母细胞瘤等。IL-10的过量分泌会导致负向调节功能增强,促进Th2细胞的分化,使抗肿瘤的细胞免疫反应受抑制。
前列腺素E2(PGE2 ):是免疫反应的生理调节因子,活化的巨噬细胞和许多肿瘤产生前列腺素,其中, PGE2能引起免疫抑制。它能诱导产生抑制性T细胞和抑制性巨噬细胞,降低淋巴因子活化的杀伤细胞活性,抑制CD3单抗诱导的T细胞增殖等。人的乳腺癌、头颈部癌的PGE2水平明显增高。上面提到人的肿瘤细胞表面的MHC分子表达的下降和缺失是肿瘤免疫逃逸的因素之一,而PGE2能下调人结肠癌细胞表面的HLA-DR分子。 PGE2合成抑制剂在体内和体外的实验,均表明可以增强抗肿瘤免疫反应。 PGE2所产生的抑制作用是与剂量相关的,在高剂量时通常呈现免疫抑制作用,而抗体的产生,Th的产生是需要低剂量的PGE2。
校对:小全 2019年11月3日
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)