
2019-10-09
近年来新的抗肿瘤药物在临床应用不断增多。传统的化疗药物靶点作用于细胞层面,在杀死癌细胞的同时对正常细胞的也存在损伤,而具有更强针对性的分子靶向药物的作用靶点在于特殊功效的分子,对肿瘤的杀伤选择性强,对正常细胞的影响明显减少,因此靶向药物日益成为肿瘤药物治疗的热点。尽管靶向药物与传统细胞毒类药物相比其毒副作用并不常见,但由于其作用的靶点如血管内皮生长因子受体、表皮生长因子受体在皮肤亦存在,因此靶向药物的皮肤不良反应也陆陆续续有报道,这些不良反应轻者影响患者的生活质量,重者甚至导致靶向药物减量或停药,影响患者的抗癌依从性,值得临床关注。本文拟就分子靶向药物的皮肤不良反应及其对策作一综述。
1.胞膜相关靶向药物抑制剂
1.1表皮生长因子受体抑制剂(Epidermal growth factor receptor inhibitors,EGFRIs)
EGF/EGFR是肿瘤细胞增殖、迁移和血管生成的关键信号转导通路,在调节皮肤的炎症、屏障功能和固有免疫亦发挥重要作用[1],因此EGFRIs的皮肤不良反应非常常见,累及50%-90%的患者。常见的皮损又被称为PRIDE综合征,“P”指丘疹脓疱性皮损(papulopustular rash)、甲沟炎(paronychia)、“R”指毛发生长调节改变(regulatory changes in hair)、“I”指瘙痒(itching)、“D”指干燥(dryness),“E”指EGFRIs[2]。此外,光敏反应也陆陆续续有报道。
脂溢部位的丘疹脓疱性疹(又称痤疮样疹)是EGFRIs最常见、最早出现的皮肤不良反应,常发生在EGFR抑制剂治疗的第1周,累及超过75%的患者,其临床表现类似于寻常痤疮,但一般不伴粉刺和结节囊肿,且常伴有瘙痒。由于EGFRIs不良反应常伴有皮肤干燥,因此不推荐外用过氧化苯甲酰或维甲酸。轻的皮损可外用弱效糖皮质激素、克林霉素或红霉素,中、重者可口服美满霉素和多西环素,对抗生素无反应者可考虑系统应用小剂量异维A酸。丘疹脓疱性疹的严重度与EGFRIs疗效和患者预后正相关。
甲沟炎是第二常见的反应,出现在治疗后1-2个月,发生于10-50%的患者,拇指和趾最常受累,常表现为甲皱襞与甲小皮肿胀皲裂、甲周化脓性肉芽肿。推荐使用抗菌肥皂预防感染、局部热敷或外用糖皮质激素,必要时系统使用四环素。
毛发改变如头发卷曲、脱色、冗细、易断、生长缓慢甚至脱发,在EGFRIs治疗数月后出现,中断用药一个月内一般均可缓解。将近一半的患者可能出现皮肤瘙痒,多数可以通过加强日常护理缓解,如避免日晒与热水烫洗,必要时系统用抗组胺药如西替利嗪、氯雷他定、多虑平等抗组胺药对症处理[3],重者可联用普瑞巴林或加巴喷丁止痒。4% ~ 35%的患者出现皮肤干燥,严重的患者可出现脂乏性湿疹和肢端皲裂,加强保湿润肤多能改善。
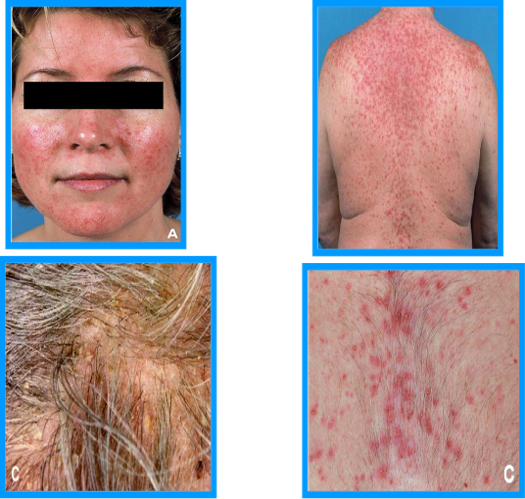
图1. EGFR-TKI所致的面部痤疮样皮疹
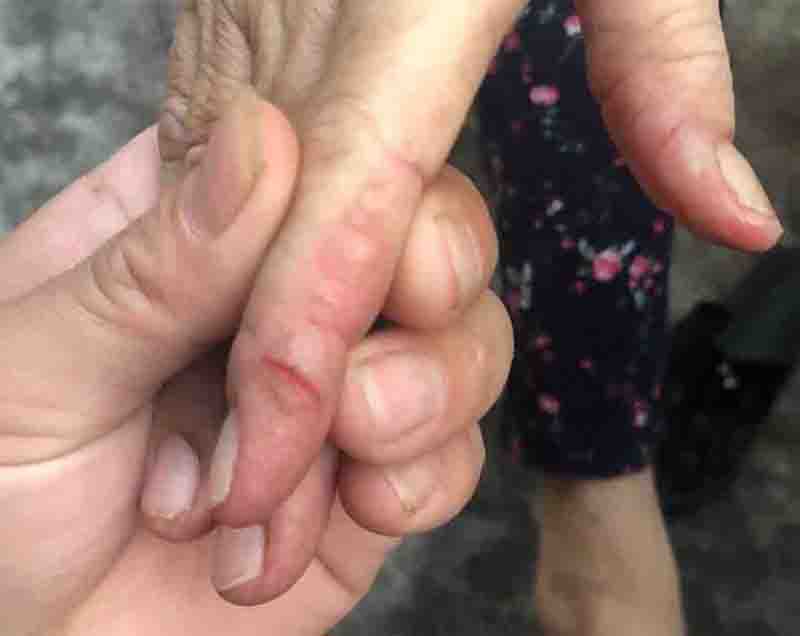
图2. EGFR-TKI所致的皮肤皲裂
1.2KIT和BCR-ABL抑制剂
KIT和BCR-ABL抑制剂是bcr-abl融合蛋白、c-Kit和血小板源性生长因子受体(platelet-derived growth factor receptors, PDGF-R)等多靶点酪氨酸激酶抑制剂,可导致一系列的皮肤毒性,且多数剂量相关,表现不严重,停药后可逆。KIT和BCR-ABL抑制剂包括第一代的伊马替尼(imatinib)和第二代的达沙替尼(dasatinib)、尼洛替尼(nilotinib),可导致水肿、色素减退和泛发的皮损。
1.2.1 水肿: 水肿一般见于伊马替尼、达沙替尼,罕见于尼洛替尼。水肿可累及眶周、肢端,偶尔导致中心液体潴留。眶周水肿是伊马替尼特征性的皮损。30%应用达沙替尼的患者可出现胸腔积液。水肿的原因推测与抑制可调节组织液平衡的PDGFR有关,其产生减少将导致真皮组织液的增加。处理一般是低盐饮食,必要时应用利尿剂,眶周水肿可外用苯肾上腺素(一种血管收缩剂)。
1.2.2 麻疹样发疹 平均用药9周后发疹,通常好发于躯干、前臂,偶然累及面部,但很少进展为严重的剥脱性皮炎。可以外用或口服激素、抗组胺药对症治疗。
1.2.3 色素改变 一方面,1/3左右的患者可以出现局限斑状或弥漫色素减退和色素脱失,一般在肤色深的个体更常见。色素减退与KIT和BCR-ABL抑制剂抑制调控黑素细胞发展、迁移和生存的c-kit蛋白有关,减量或停药是可逆的[4]。而另一方面,3.6%的患者可出现甲、毛发、口腔黏膜的色素沉着,这是与含黑色素与铁的药物代谢产物沉积有关[5]。
1.2.4 其他皮损 临床上也有荨麻疹样、苔藓样、糠疹样、银屑病样皮损、Stevens-Johnson 综合征[6],急性泛发性发疹性脓疱性皮病、Sweet 综合征的报道,罕见的表现包括蕈样肉芽肿样、毛囊性黏蛋白病、迟发性卟啉病、穿通性毛囊炎[3, 7]等。
1.3 血管生成抑制剂
新血管形成为快速增生的肿瘤细胞提供氧气,因此针对血管生成靶点的药物可以减少肿瘤组织中微血管的形成,影响血管壁的通透,从而抑制肿瘤的生长,但同时也会导致皮肤黏膜出血和伤口愈合不良。选择性抑制血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)靶向药物主要是抗VEGFR的单克隆抗体贝伐单抗(bevacizumab)、兰尼单抗(ranibizumab)。皮肤黏膜有出血倾向时不推荐使用VEGF抑制剂。若考虑联合手术时须考虑到VEGF抑制剂影响伤口愈合的潜在风险。
1.4 多靶点酪氨酸激酶抑制剂
多靶点酪氨酸激酶抑制剂除了靶向抑制VEGFR,还可拮抗其他酪氨酸激酶受体,如PDGFR、EGFR、KIT、RET、Flt3和RAF,从而发挥抑制肿瘤细胞血管生成和增殖的作用,但与此同时,也会带来独特的和其他靶向药物相似的皮肤毒性。常见的多靶点酪氨酸激酶抑制剂包括索拉非尼和舒尼替尼。74%应用索拉非尼、81%应用舒尼替尼的患者会出现皮肤反应[8]。
常见的皮肤反应包括角化过度的手足综合征、皮肤干燥、瘙痒、色泽改变、口腔反应、毛发、指(趾)甲改变等[3],发病机制可能与多激酶抑制剂拮抗VEGFR 和PDGFR导致血管损伤或与药物的直接毒性反应有关。角化过度的手足综合征(Hand-foot skin reactions,HFSRs)和口腔炎是最常见的副反应。索拉非尼还可导致皮肤鳞状细胞癌或日光性角化病。
1.4.1 手足综合征
发病机制可能与VEGF抑制、血管退行和继发血管修复能力下调有关。血管生成诱导抑制剂相关的手足综合征与与阿糖胞苷、氟尿嘧啶、表阿霉素传统化疗药物所导致的手足综合征有所不同。后者常表现为对称性境界清楚的可形成水疱和溃疡的掌跖红斑。而前者皮损常局限于摩擦和外伤易感部位,如足跟、足跖侧缘。一般在用药2-4周后掌跖部位出现伴有角化过度和浅表水疱的对称性水肿性疼痛性炎性红斑,重者导致跛行。有时红斑也会出现在指端、甲周。皮疹常呈剂量依赖性.停药后迅速消退,有些患者减药后再次用药不再出现皮疹。建议患者用药前应穿着宽松、有弹性的鞋子。轻度患者,无伴疼痛,仅需应用润肤霜保护病变皮肤,穿戴保护性的手套、鞋袜以减少摩擦,避免手足接触化学类物品,维持病变部位皮肤完整性,预防皮肤感染发生。必要时使用角质溶解药物,如尿素或他扎罗汀。中度患者出现痛性皮损限制了日常起居活动,可以加用普瑞巴林(乐瑞卡)或非甾体类药物止痛、局部外用氯倍他索和外用利多卡因,并考虑药物减半量观察1-4周。重度影响日常生活自理,需要外用抗菌液,并停药至少1周直至症状明显改善[3]。
1.4.2 口腔并发症
口腔炎是第二常见的不良反应。一般发生在治疗早期,与手足综合征的严重度直接相关。治疗建议保持口腔卫生,每日饭前及睡前刷牙漱口;尽量吃软食.不吃刺激性食物。口腔溃疡较轻时,可局部外用糖皮质激素;对中度或重度口腔疼痛者,可局部用麻醉剂和抗菌剂等[9]。
1.4.3 毛发异常
脱发发生于开始治疗后的2-28周,分别发生于26%索拉非尼组与6%舒尼替尼组的患者。索拉非尼所致的脱发皮损区新长出的毛发变脆、卷曲而且色素加深。与之相反,舒尼替尼却导致10%的患者出现毛发色素脱失,这与舒尼替尼影响具有调节酪氨酸酶(黑素合成关键酶)的干细胞因子受体通路有关。这种毛发色素脱失一般在舒尼替尼治疗5-6周时出现,停止治疗2-3周后恢复。
1.4.4 颜面红斑
像脂溢性皮炎样的颜面红斑发生于63%应用索拉非尼的患者,舒尼替尼相对少见。表现用药l~2周后患者颜面T形区及头皮部位可出现红色斑疹,常伴有头皮感觉麻木。皮疹一般在停药2个月内消退。绝大多数颜面红斑的患者不需要任何治疗。
1.4.5 指甲
部分患者指端可出现无痛性甲下裂片样出血,较少出现在足趾。发生机制可能与药物阻断VEGFR导致甲床部位的毛细血管生理性修复功能受损有关。甲下裂片样出血可随指甲生长逐渐消失,无需特殊处理。
1.4.6 皮肤色素异常
28%应用舒尼替尼的患者会发生皮肤变黄,通常发生于颜面,不累及巩膜和口腔黏膜。通常特征性地发生于治疗的第一到第四周,停药后可自发消退。这种色素异常与舒尼替尼本身与其代谢产物都是黄色有关[10]。
1.4.6 皮肤肿瘤
10%应用舒尼替尼的患者可出现新的鳞状细胞癌和已存在的日光性角化病皮损发生炎症反应。这些转化的皮损中检测到多种致癌基因的突变,有学者猜测舒尼替尼可能存在促进角质形成细胞增殖和激活正常皮肤中的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK) 通路的潜能,再加上紫外线诱导突变的协同作用,从而导致良性皮损演化呈具增殖倾向的皮损乃至恶性肿瘤。
1.4.7 其他反应
包括始发颜面向心性扩散的麻疹样疹、发疹性黑素细胞痣[11]、泛发性毛发角化样皮损、躯干脱毛、乳头角化过度、表皮囊肿等陆陆续续有报道[3]。
2. 胞内信号通路抑制剂
RAS-RAF-MEK-ERK通路与 PI3K-AKT- mTOR 是两条重要的胞内信号转导通路,在细胞的生长、存活、增殖、凋亡、血管生成、自噬等过程中发挥着极其重要的生物学功能,其调节异常与许多肿瘤的发生相关。这两条通路存在通过共同的信号蛋白 RAS(也是一种致癌蛋白)发生紧密的交互影响[12]。
2.1 RAS-RAF-MEK-ERK 通路
2.1.1 RAF抑制剂
BRAF基因全名为鼠类肉瘤滤过性毒菌致癌基因同源体B1(v-raf murine sarcoma viral oncogene homolog B1),属于RAF基因家族。BRAF位于人染色体7q34,有19个外显子,其中外显子11-15编码激酶区,即丝氨酸/苏氨酸蛋白激酶。BRAF蛋白主要位于神经及睾丸组织,是RAS-RAF-MEK-ERK(MAPK)信号通路中的上游调节因子,也是人类肿瘤最常见的突变的蛋白激酶之一。RAF蛋白磷酸化激活其下游底物丝氨酸/苏氨酸蛋白激酶(MEK)和胞外信号调节激酶(ERK),MEK和ERK磷酸化可继而调节细胞增殖、分化和凋亡。最常见的BRAF基因突变为BRAF V600E,即发生在第15号外显子第1799位核苷酸T-A的转换,导致蛋白质产物中第600位缬氨酸(V)被谷氨酸(E)替代[13]。该突变可使BRAF激酶持续激活,引起MEK/ERK信号转导紊乱,最终导致细胞过度增殖、恶变。
超过80%的皮肤黑素瘤患者发生MAPK信号通路的遗传突变,最常见的突变为BRAF V600E,BRAF抑制剂威罗菲尼和达拉菲尼可选择性抑制BRAF V600E癌蛋白,阻断细胞过度增殖。BRAF抑制剂是最常见毒性反应发生于皮肤,累及约74%的患者[4]。其皮肤不良反应类似EGFRIs,这也许与RAF蛋白也是EGFR信号通路关键的介质有关。抑制角质形成细胞MAPK通路,导致角质形成细胞死亡、细胞迁移受阻以及炎症,继而导致皮肤不良反应。
2.1.1.1 发疹性皮损
该反应是剂量依赖性,发生于治疗开始的前几个月,停药或减量后可消退。通常表现为发生于颜面、躯干和手臂的丘疹脓疱,也可进而融合为麻疹样或中毒性红斑样皮损。轻度皮损局部外用润肤剂,必要时口服抗组胺药、局部外用激素,重度患者需要系统用糖皮质激素5-7天,必要时暂时中断治疗,待症状缓解后可逐步加量回到原来的治疗剂量。
2.1.1.2 表皮新生物
表皮新生物的发生推测与RAF抑制剂暴露角质形成细胞早已存在的隐匿的日光诱导的RAS突变有关,不排除病毒诱发的细胞转化参与发病。各种良恶性角化皮损如疣状角化病、鳞状细胞癌和角化棘皮瘤发生于开始治疗后的2-14周。其中泛发的表现为疣状白色丘疹的疣状角化病最为常见[4, 14, 15],病理学上可见乳头瘤样增生、角化过度伴轻度不典型增生,但没有病毒导致的细胞病理学改变,人类乳头瘤病毒免疫组化也为阴性。发生鳞状细胞癌的患者通常年龄较大,多数发生于开始治疗的前6个月内,细胞分化一般较好。针对各种表皮新生物治疗手段包括冷冻、激光或手术切除,药物剂量一般无需调整。对多发的早期鳞状细胞癌,可考虑冷冻、系统应用维甲酸或光动力治疗。建议所有的应用BRAF抑制剂的患者用药初应进行全身皮肤基线检查,对于伴有先前存在的光损害皮损的患者用药期间应每2-4周随访皮疹变化[12]。
2.1.1.3 光敏性
7-12%应用威罗菲尼的患者可发生光敏。因此建议应用BRAF抑制剂的患者应限制日晒,常规使用宽谱防晒霜(特别是防护长波紫外线)和穿防护紫外线的衣服。
2.1.1.4 其他反应
应用BRAF抑制剂者可发生皮肤干燥、瘙痒、皲裂、毛周角化病样皮损[16]、甲沟炎、脱发、角化过度性手足反应[16, 17]、脂膜炎等,处理对症为主。其中脂膜炎样痛性结节可加予非甾体类抗炎药减轻症状,无需停药。此外,还有发疹性粟丘疹、表皮囊肿、棘层松解性皮病等报道[12]。
2.1.2 MEK抑制剂
MEK抑制剂相关皮肤毒性与EGFR抑制剂所致皮损很相似,常表现为麻疹样发疹、丘疹脓疱样发疹、皮肤干燥、甲沟炎,处理策略相同。
2.2 PI3K-AKT-mTOR通路抑制剂
哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin,mTOR) 是一种丝氨酸/苏氨酸蛋白激酶,它主要通过PI3K/Akt/mTOR途径来调控细胞生长、增殖、细胞周期[18]。mTOR 抑制剂除了主要抑制 mTOR 信号通路抗肿瘤作用外,还具有抑制肿瘤血管生成与免疫抑制的作用。皮肤不良反应包括口腔炎、炎症性发疹、甲改变等。口腔炎不同于传统化疗或放疗所导致的伴假膜形成的大片融合宽基底溃疡,表现为散在、孤立、浅表性口腔溃疡,通常呈剂量依赖。轻度以普通漱口水(不含酒精、过氧化氢)漱口为主,中重度包括局部外用麻醉剂和(或)强效激素。炎症性发疹形态包括麻疹样、湿疹样和痤疮样皮疹。一般发生于治疗开始的数周,最常累及躯干、四肢、头颈,皮疹的起始、经过和处理类似于EGFRIs抑制剂相关丘疹脓疱样疹。甲改变最常见的不良反应是甲沟炎。此外,脱发、面部多毛、伤口愈合不良、瘙痒、干皮症、血管炎等亦有报道。
2.3 Hedgehog信号通路抑制剂
几乎所有的基底细胞癌患者均存在Hedgehog信号通路的基因异常改变。Vismodegib是一种小分子化合物,通过结合至Hedgehog通路信号传导中重要的SMO受体(smoothened receptor),抑制在基底细胞癌中异常活化的Hedgehog通路,是2012年美国食品与药物管理局(FDA)批准的针对转移基底细胞癌、无法手术或放射治疗的局限性晚期基底细胞癌的第一个药物。常见的皮肤黏膜不良反应是脱发和味觉障碍。脱发通常可逆,且一般累及少于50%的头发。对心理有压力的患者建议戴假发,局部外用米诺地尔可缩短脱发持续时间,但不能预防脱发。
2.4 免疫调节剂
目前免疫调节剂主要针对“免疫关卡”,如T细胞表达的抑制受体,包括细胞毒性T淋巴细胞抗原(cytotoxic T lymphocyte-associated antigen 4,CTLA-4))和程序性死亡-1受体(programmed death 1,PD-1),从而活化免疫系统,促进癌细胞的清除。常见的免疫相关皮肤不良反应包括皮炎、瘙痒和白癜风,通常是剂量相关,具有可逆性。
2.4.1 CTLA-4抑制剂
伊匹单抗(ipilimumab),它是一种免疫修饰的单克隆抗体,可以促进非限制性T细胞活化攻击肿瘤细胞。已经被美国FDA批准用于转移性黑素瘤的免疫治疗。伊匹单抗可导致免疫相关不良反应事件(immune-related adverse events,IRAEs),最常见的IRAEs其中之一发生在皮肤,主要表现为瘙痒、麻疹样发疹、白癜风样黑素瘤相关色素减退(vitiligo-like melanoma-associated hypopigmentation,MAH)[12, 18],IRAEs一般发生于治疗开始后的3-6周,瘙痒性皮疹主要分布于近端伸侧、躯干,伴有外周血嗜酸性粒细胞增多。通常多数患者外用糖皮质激素与尿素即可缓解皮疹,无需停药或减量。严重皮损者可按相当于强的松1-2mg/kg/d的用量系统用糖皮质激素,当坏死、大疱或出血性皮损发生则须停药。
2.4.2 PD-1抑制剂
包括白癜风、各种皮肤发疹损害和瘙痒。治疗主要是对症。
2.5 蛋白酶体抑制剂
硼替佐米(Bortezomib)是世界第一个闻世的蛋白酶体抑制剂,可抑制kappB蛋白的降解、NF-kappaB的活化,促进肿瘤细胞凋亡,应用于多发性骨髓瘤、非何杰金淋巴瘤和套细胞淋巴瘤。已报道的皮肤不良反应发生率约10%-24%[4]。与该药促进炎症细胞因子的释放有关。硼替佐米导致的皮损形式多样,包括红斑、丘疹、结节、斑块、溃疡等。皮下注射给药者常见在注射部位出现皮肤反应。皮损一般发生在治疗的第三或第四个周期,可在末次给药5-7天后消退,必要时可加予系统用抗组胺药和糖皮质激素对症处理。
总之,靶向药物的皮肤不良反应很常见,多数患者的皮肤不良反应通过培养良好的生活方式,加强皮肤护理,必要时系统对症处理均可耐受。且多数患者的皮肤不良反应事件呈治疗剂量依赖,与临床疗效相关,因此,正确对待靶向药物的皮肤不良反应很重要。防治的要点在于首先应确定病变程度,轻度及中度不良反应进行对症治疗,无需调整药物剂量,而重度皮疹经处理后不能缓解的则考虑减量或者停药。靶向抗肿瘤药物由于其上市时间尚短,需要多学科密切关注用药期间可能出现的各种不良反应,共商应对之策。
发表时间:2015-06-26 00:58:58
修改:2019-10-09
【参考文献】
[1] Lichtenberger B M, Gerber P A, Holcmann M, et al. Epidermal EGFR controls cutaneous host defense and prevents inflammation[J]. Sci Transl Med,2013,5(199):111r-199r.
[2] Madke B, Gole P, Kumar P, et al. Dermatological Side Effects of Epidermal Growth Factor Receptor Inhibitors: 'PRIDE' Complex[J]. Indian J Dermatol,2014,59(3):271-274.
[3] Macdonald J B, Macdonald B, Golitz L E, et al. Cutaneous adverse effects of targeted therapies: Part I: Inhibitors of the cellular membrane[J]. J Am Acad Dermatol,2015,72(2):203-218, 219-220.
[4] Reyes-Habito C M, Roh E K. Cutaneous reactions to chemotherapeutic drugs and targeted therapy for cancer: Part II. Targeted therapy[J]. J Am Acad Dermatol,2014,71(2):211-217, 227-228.
[5] Li C C, Malik S M, Blaeser B F, et al. Mucosal pigmentation caused by imatinib: report of three cases[J]. Head Neck Pathol,2012,6(2):290-295.
[6] Bois E, Holle L M, Farooq U. Late onset imatinib-induced Stevens-Johnson syndrome[J]. J Oncol Pharm Pract,2014,20(6):476-478.
[7] Llamas-Velasco M, Steegmann J L, Carrascosa R, et al. Perforating folliculitis in a patient treated with nilotinib: a further evidence of C-kit involvement[J]. Am J Dermatopathol,2014,36(7):592-593.
[8] Lee W J, Lee J L, Chang S E, et al. Cutaneous adverse effects in patients treated with the multitargeted kinase inhibitors sorafenib and sunitinib[J]. Br J Dermatol,2009,161(5):1045-1051.
[9] Boers-Doets C B, Epstein J B, Raber-Durlacher J E, et al. Oral adverse events associated with tyrosine kinase and mammalian target of rapamycin inhibitors in renal cell carcinoma: a structured literature review[J]. Oncologist,2012,17(1):135-144.
[10] Mclellan B, Kerr H. Cutaneous toxicities of the multikinase inhibitors sorafenib and sunitinib[J]. Dermatol Ther,2011,24(4):396-400.
[11] Jimenez-Gallo D, Albarran-Planelles C, Linares-Barrios M, et al. Eruptive melanocytic nevi in a patient undergoing treatment with sunitinib[J]. JAMA Dermatol,2013,149(5):624-626.
[12] Macdonald J B, Macdonald B, Golitz L E, et al. Cutaneous adverse effects of targeted therapies: Part II: Inhibitors of intracellular molecular signaling pathways[J]. J Am Acad Dermatol,2015,72(2):221-236, 237-238.
[13] Forbes S A, Bindal N, Bamford S, et al. COSMIC: mining complete cancer genomes in the Catalogue of Somatic Mutations in Cancer[J]. Nucleic Acids Res,2011,39(Database issue):D945-D950.
[14] Chu E Y, Wanat K A, Miller C J, et al. Diverse cutaneous side effects associated with BRAF inhibitor therapy: a clinicopathologic study[J]. J Am Acad Dermatol,2012,67(6):1265-1272.
[15] Sufficool K E, Hepper D M, Linette G P, et al. Histopathologic characteristics of therapy-associated cutaneous neoplasms with vemurafenib, a selective BRAF kinase inhibitor, used in the treatment of melanoma[J]. J Cutan Pathol,2014,41(7):568-575.
[16] Huang V, Hepper D, Anadkat M, et al. Cutaneous toxic effects associated with vemurafenib and inhibition of the BRAF pathway[J]. Arch Dermatol,2012,148(5):628-633.
[17] Boussemart L, Routier E, Mateus C, et al. Prospective study of cutaneous side-effects associated with the BRAF inhibitor vemurafenib: a study of 42 patients[J]. Ann Oncol,2013,24(6):1691-1697.
[18] Lim H J, Crowe P, Yang J L. Current clinical regulation of PI3K/PTEN/Akt/mTOR signalling in treatment of human cancer[J]. J Cancer Res Clin Oncol,2015,141(4):671-689.
推荐阅读
文章评论
注册或登后即可发表评论
登录/注册
全部评论(0)